حمض الهيدروديك (HI) هو حمض قوي يتكون من الهيدروجين واليود. يتم استخدامه في التخليق العضوي وكعامل اختزال. إنه تآكل للغاية ويتطلب معالجة دقيقة.
| اسم الأيوباك | حمض الهيدروديك |
| الصيغة الجزيئية | أهلاً |
| CAS رقم | 10034-85-2 |
| المرادفات | حمض الهيدروديك، يوديد الهيدروجين، اليود |
| إنتشي | إنتشي = 1S/HI/h1H |
خصائص حمض الهيدروديك
صيغة حمض الهيدروديك
الصيغة الكيميائية ليوديد الهيدروجين هي HI. وتتكون من ذرة هيدروجين (H) مرتبطة بذرة اليود (I). تمثل هذه الصيغة البسيطة تركيبة هذا الحمض القوي.
الكتلة المولية لحمض الهيدروديك
تبلغ الكتلة المولية ليوديد الهيدروجين (HI) حوالي 127.91 جرامًا لكل مول (جم / مول). يتم حساب هذه القيمة عن طريق جمع الكتل الذرية لذرة الهيدروجين وذرة اليود.
نقطة غليان حمض الهيدروديك
يوديد الهيدروجين لديه نقطة غليان منخفضة نسبيًا، حوالي -35 درجة مئوية (-31 درجة فهرنهايت). عند درجة الحرارة هذه، يتغير الشكل السائل لـ HI إلى الحالة الغازية.
نقطة انصهار حمض الهيدروديك
تبلغ نقطة انصهار يوديد الهيدروجين حوالي -51 درجة مئوية (-60 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول الشكل الصلب لـ HI إلى الحالة السائلة.
كثافة حمض الهيدروديك جم / مل
تبلغ كثافة يوديد الهيدروجين حوالي 2.85 جرام لكل ملليلتر (جم / مل). يشير قياس الكثافة هذا إلى كتلة HI الموجودة في ملليلتر واحد من المادة.
حمض الهيدروديك الوزن الجزيئي
يوديد الهيدروجين لديه الوزن الجزيئي حوالي 127.91 جم / مول. هذه القيمة هي مجموع الأوزان الذرية للهيدروجين واليود في جزيء HI.
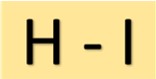
هيكل حمض الهيدروديك
يحتوي حمض الهيدروديك (HI) على بنية بسيطة. وتتكون من ذرة هيدروجين مرتبطة بذرة اليود برابطة تساهمية واحدة. هذا الترتيب الجزيئي يعطي HI خصائصه المميزة.
ذوبان حمض الهيدروديك
حمض الهيدروديك لديه قابلية عالية للذوبان في الماء. عند مزجه بالماء، فإنه يذوب بسهولة ليشكل محلول عديم اللون. وتساهم قابليته العالية للذوبان في استخدامه على نطاق واسع في مختلف التطبيقات، بما في ذلك التركيب الكيميائي.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 2.85 جرام/مل |
| لون | عديم اللون |
| يشم | فدان |
| الكتلة المولية | 127.91 جرام/مول |
| كثافة | 2.85 جرام/مل |
| نقطة الانصهار | -51 درجة مئوية (-60 درجة فهرنهايت) |
| نقطة الغليان | -35 درجة مئوية (-31 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | امتزاج، وتشكيل حل عديم اللون |
| الذوبان | قابل للذوبان في المذيبات العضوية |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | -عشرة |
| الرقم الهيدروجيني | حمضية جدًا (الرقم الهيدروجيني <1) |
سلامة ومخاطر حمض الهيدروديك
يشكل يوديد الهيدروجين (HI) مخاطر كبيرة على السلامة بسبب طبيعته المسببة للتآكل. يمكن أن يسبب حروقًا شديدة في الجلد وتلفًا في العين عند ملامسته. استنشاق أبخرةه يسبب تهيج الجهاز التنفسي. يجب استخدام معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع HI. يجب أن يتم تخزينه في منطقة جيدة التهوية، بعيدا عن المواد غير المتوافقة. في حالة ابتلاعه أو استنشاقه عن طريق الخطأ، اطلب العناية الطبية على الفور. في حالة الانسكاب، قم بتحييده باستخدام العوامل المناسبة والتخلص منه كنفايات خطرة. من الضروري اتباع بروتوكولات السلامة الصارمة والتعامل بحذر لتجنب الحوادث والإصابات.
| رموز الخطر | تآكل |
| وصف الأمان | يسبب حروقا جلدية شديدة وتلفا للعين. ضار إذا تم استنشاقه. |
| أرقام تعريف الأمم المتحدة | UN1787 |
| رمز النظام المنسق | 28111990 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | ثانيا |
| تسمم | سام جدا |
طرق تصنيع حمض الهيدروديك
يمكن تصنيع يوديد الهيدروجين (HI) بطرق مختلفة. يتضمن النهج الشائع التفاعل المباشر لليود (I2) مع الفوسفور الأحمر (P). في هذه الطريقة، يتم خلط I2 مع الفوسفور الأحمر، الذي يعمل كعامل اختزال. ويحدث التفاعل في وجود الماء، ويعطي حمض الفوسفوريك وHI.
تتضمن الطريقة الأخرى تفاعل اليود مع هيدرات الهيدرازين (N2H4·H2O). تتطلب هذه العملية معالجة دقيقة بسبب الطبيعة الخطرة المحتملة لهيدرات الهيدرازين. يؤدي التفاعل إلى تكوين غاز HI وغاز النيتروجين.
وبدلاً من ذلك، فإن تفاعل اليود مع حمض الكبريتيك المركز (H2SO4) يمكن أن ينتج أيضًا HI. في هذه الطريقة، يتم خلط اليود مع حمض الكبريتيك المركز، مما يؤدي إلى توليد غاز HI، والذي يمكن جمعه وتكثيفه في شكل سائل.
ومن الضروري ملاحظة أن تخليق يوديد الهيدروجين يجب أن يتم مع احتياطات السلامة المناسبة. يمكن أن تكون المواد الكيميائية المعنية خطرة ويمكن أن تولد التفاعلات غازات سامة. تعد التهوية المناسبة ومعدات الحماية والالتزام باحتياطات السلامة أمرًا بالغ الأهمية أثناء عملية التوليف لضمان إنتاج آمن وناجح ليوديد الهيدروجين.
استخدامات حمض الهيدروديك
يجد يوديد الهيدروجين (HI) تطبيقات مختلفة في مختلف الصناعات بسبب خصائصه الفريدة. فيما يلي بعض الاستخدامات الرئيسية:
- التخليق العضوي: تستخدم الكيمياء العضوية HI كمتفاعل أساسي لتحويل هاليدات الألكيل إلى ألكانات، وهي عملية تعرف باسم إزالة الهالوجين.
- الصناعة الدوائية: إنتاج المركبات الصيدلانية المختلفة بما في ذلك الأدوية المحتوية على اليود وعوامل التباين الميودنة للتصوير الطبي المتعلقة بـ HI.
- عامل اختزال: يعمل HI بشكل فعال كعامل اختزال قوي في التفاعلات الكيميائية، مما يساعد في اختزال أيونات المعادن إلى أشكالها العنصرية.
- التحفيز: يشارك HI بنشاط كمحفز في بعض التفاعلات الكيميائية، مما يزيد من معدلات التفاعل ويحسن إنتاج تحولات معينة.
- التنظيف والحفر: تستخدم صناعات الإلكترونيات وأشباه الموصلات حمض الهيدروكلوريك بنشاط في عمليات التنظيف والحفر نظرًا لقدرته على إذابة المعادن وأكاسيد المعادن.
- الكيمياء التحليلية: تستخدم المعايرة اليودومترية في الكيمياء التحليلية HI بشكل فعال لتحديد تركيز بعض المواد بناءً على تفاعلها مع اليود.
- معالجة الأسطح المعدنية: تلعب HI دورًا نشطًا في إعداد الأسطح المعدنية للطلاء والنحاس وعمليات معالجة الأسطح الأخرى.
- تصنيع اليوديد: تستخدم العديد من الصناعات HI بنشاط لإنتاج مركبات اليوديد لتطبيقات مختلفة في مجالات مثل التصوير الفوتوغرافي والطب والتوليف العضوي.
- كاشف المختبر: تستخدم المختبرات بنشاط HI ككاشف مفيد للعديد من التفاعلات والتجارب الكيميائية.
إن الخصائص المتنوعة ليوديد الهيدروجين تجعله أداة قيمة في الأبحاث الكيميائية والعمليات الصناعية وتطوير الأدوية، مما يساهم في التقدم في قطاعات متعددة والاكتشافات العلمية.
أسئلة:
س: ما المركب الذي يمكن إضافته إلى حمض الهيدريوديك (HI) لتحييد خواصه الحمضية؟
ج: يمكن إضافة قاعدة، مثل هيدروكسيد الصوديوم (NaOH)، لتحييد يوديد الهيدروجين وتكوين الماء والملح.
س: هل حمض الهيدروديك حمض قوي؟
ج: نعم، يوديد الهيدروجين حمض قوي، مما يعني أنه يتأين بالكامل في الماء، ويطلق أيونات الهيدروجين.
س: ما هي صيغة حمض الهيدروديك؟
ج: صيغة يوديد الهيدروجين هي HI، وتمثل ذرة الهيدروجين المرتبطة بذرة اليود.
س: أي مما يلي هو صيغة حمض الهيدروديك؟
ج: صيغة يوديد الهيدروجين هي HI.
س: ما عدد المليليترات اللازمة من حمض الهيدروديك 0.550 M للتفاعل مع 10.00 ml من 0.217 M CsOH؟
ج: يلزم حوالي 17.58 مل من يوديد الهيدروجين 0.550 مولار للتفاعل مع 10.00 مل من 0.217 مولار CsOH.
س: هل حمض الهيدروديك غير قانوني؟
ج: يوديد الهيدروجين في حد ذاته ليس غير قانوني، ولكن قد يتم تنظيم استخدامه وحيازته بسبب مخاطره المحتملة وتطبيقاته في الأنشطة غير القانونية.
س: ماذا يتكون يوديد الهيدروجين وكبريتيد المغنيسيوم؟
ج: يتفاعل يوديد الهيدروجين وكبريتيد المغنيسيوم لتكوين غاز كبريتيد الهيدروجين (H2S) وملح يوديد المغنيسيوم (MgI2).
س: ماذا يحدث عند خلط يوديد الهيدروجين مع صودا الخبز؟
ج: عندما يتفاعل يوديد الهيدروجين مع صودا الخبز (بيكربونات الصوديوم)، ينتج ثاني أكسيد الكربون والماء ويوديد الصوديوم.
س: كيف يعمل يوديد الهيدروجين في الماء؟
ج: يتأين يوديد الهيدروجين في الماء، ويطلق أيونات الهيدروجين (H+) وأيونات اليوديد (I-)، مما يؤدي إلى محلول شديد الحموضة.
س: المعادلة الأيونية الصافية لهيدروكسيد الصوديوم ويوديد الهيدروجين؟
ج: المعادلة الأيونية الصافية للتفاعل بين هيدروكسيد الصوديوم (NaOH) ويوديد الهيدروجين (HI) هي Na+ + OH- + H+ + I- → Na+ + I- + H2O.
