خلات الرصاص (Pb(OAc)₂) عبارة عن مركب بلوري أبيض. يستخدم في صبغات الشعر لقدرته على تغميق الشعر. ومع ذلك، فإنه يشكل مخاطر صحية ويجب التعامل معه بحذر.
| اسم الأيوباك | خلات الرصاص (II). |
| الصيغة الجزيئية | الرصاص (OAc)₂ |
| CAS رقم | 301-04-2 |
| المرادفات | إيثانولات الرصاص (II)، خلات الرصاص، ثنائي أسيتات الرصاص |
| إنتشي | InChI=1S/2C2H4O2.Pb/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
خصائص خلات الرصاص
صيغة خلات الرصاص
الصيغة الكيميائية لثنائي أسيتات الرصاص هي Pb(OAc)₂، حيث يمثل Pb رمز الرصاص ويشير OAc إلى الأيون CH₃COO⁻. إنه مركب بلوري أبيض يحتوي على أيونات CH₃COO⁻ لكل ذرة رصاص.
خلات الرصاص الكتلة المولية
يحتوي ثنائي أسيتات الرصاص على كتلة مولية تبلغ حوالي 325.29 جم / مول. لحساب ذلك، نجمع الكتل الذرية لذرة Pb وأيونات CH₃COO⁻ الموجودة في صيغتها الكيميائية.
نقطة غليان خلات الرصاص
تبلغ نقطة غليان ثنائي أسيتات الرصاص حوالي 280 درجة مئوية (536 درجة فهرنهايت). عند تعرضه لدرجات حرارة عالية، فإنه يمر بمرحلة انتقالية من الحالة الصلبة إلى الحالة السائلة، مما يجعل من الضروري التعامل معه بحذر.
نقطة انصهار خلات الرصاص
يحتوي ثنائي أسيتات الرصاص على نقطة انصهار تبلغ حوالي 280 درجة مئوية (536 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول المركب الصلب إلى سائل، مما يجعله مناسبًا لتطبيقات معينة مثل صبغات الشعر.
كثافة خلات الرصاص جم/مل
تبلغ كثافة ثنائي أسيتات الرصاص حوالي 3.25 جم / مل. تمثل هذه القيمة كتلة المركب لكل وحدة حجم وهي مهمة لفهم خصائصه الفيزيائية وتطبيقاته.
الوزن الجزيئي لخلات الرصاص
يبلغ الوزن الجزيئي لثنائي أسيتات الرصاص حوالي 325.29 جم / مول. فهو يوفر معلومات أساسية لمختلف الحسابات الكيميائية ويساعد الباحثين على فهم سلوكها وتفاعلها.
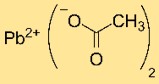
هيكل خلات الرصاص
يحتوي ثنائي أسيتات الرصاص على بنية بلورية تحتوي على كاتيونات Pb²⁺ منسقة مع أيونات CH₃COO⁻. ترتيب الذرات والروابط في الشبكة البلورية يحدد استقرارها وخصائصها.
ذوبان خلات الرصاص
ثنائي أسيتات الرصاص قابل للذوبان بشكل سيئ في الماء. يذوب إلى حد ما ليشكل محلولًا واضحًا عديم اللون. وتختلف قابلية ذوبانه باختلاف درجة الحرارة، مما يجعل تخزينه ومعالجته بشكل سليم أمرًا ضروريًا لتجنب التلوث البيئي.
| مظهر | أبيض بلوري |
| جاذبية معينة | ~3.25 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | ~325.29 جم/مول |
| كثافة | ~3.25 جم/مل |
| نقطة الانصهار | ~280 درجة مئوية (536 درجة فهرنهايت) |
| نقطة الغليان | ~280 درجة مئوية (536 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | ضعيف الذوبان |
| الذوبان | محدودية الذوبان، تختلف باختلاف درجة الحرارة |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | غير متاح |
سلامة ومخاطر خلات الرصاص
يشكل ثنائي أسيتات الرصاص مخاطر كبيرة على السلامة ويجب التعامل معه بحذر شديد. وهو سام إذا تم تناوله أو استنشاقه أو امتصاصه عن طريق الجلد. التعرض لفترات طويلة يمكن أن يؤدي إلى التسمم بالرصاص، مما يؤدي إلى آثار صحية ضارة، بما في ذلك الجهاز العصبي والكلى. تجنب ملامسة العينين والجلد، والملابس. استخدم التهوية الكافية ومعدات الحماية الشخصية عند التعامل. منع إطلاقها في البيئة لأنها يمكن أن تلوث التربة والمياه، مما يؤثر على النظم البيئية. يبقيه بعيدا عن متناول الأطفال والحيوانات. تخلص منه بشكل صحيح وفقًا للوائح المحلية. بشكل عام، يعد الالتزام الصارم بإرشادات السلامة أمرًا بالغ الأهمية لتقليل المخاطر.
| رموز الخطر | المخاطر الصحية، المخاطر البيئية |
| وصف الأمان | سامة ومضرة بالبيئة |
| أرقام تعريف الأمم المتحدة | UN1616 |
| رمز النظام المنسق | 29152900 |
| فئة الخطر | 6.1 (المواد السامة) |
| مجموعة التعبئة | ثانيا |
| تسمم | سام جدا |
طرق تصنيع خلات الرصاص
هناك عدة طرق لتجميع ثنائي أسيتات الرصاص.
الطريقة الشائعة هي تفاعل الرصاص المعدني مع حمض الأسيتيك . في هذه الطريقة، عادةً ما تضيف الرصاص إلى الحاوية وتصب حمض الأسيتيك ببطء في الحاوية مع التحكم في الظروف مثل التحريك وتنظيم درجة الحرارة. ويستمر التفاعل مكونًا ثنائي أسيتات الرصاص كراسب أبيض.
تتضمن الطريقة الأخرى تفاعل أكسيد الرصاص (PbO) أو كربونات الرصاص (PbCO₃) مع حمض الأسيتيك الجليدي. تقوم بخلط أكسيد الرصاص أو كربونات الرصاص مع حمض الأسيتيك وتسخين الخليط، مما يسبب تفاعلًا ينتج عنه ثنائي أسيتات الرصاص.
هناك طريق تخليق آخر يتكون من تنفيذ تفاعل الإزاحة المزدوجة لـ Pb(NO₃)₂ مع CH3COONa في محلول مائي. ينتج عن هذا التفاعل ثنائي أسيتات الرصاص على شكل راسب.
ومن الضروري التعامل مع هذه الأساليب الاصطناعية بحذر بسبب سمية مركبات الرصاص. يجب عليك اتباع تدابير السلامة المناسبة وإجراء العمليات في مناطق جيدة التهوية مع معدات الحماية المناسبة. بالإضافة إلى ذلك، فإن اتباع لوائح التخلص من النفايات أمر بالغ الأهمية لمنع التلوث البيئي.
استخدامات خلات الرصاص
يجد ثنائي أسيتات الرصاص العديد من التطبيقات نظرًا لخصائصه الفريدة. فيما يلي بعض الاستخدامات:
- صبغات الشعر : تستخدم بعض صبغات الشعر ثنائي أسيتات الرصاص لتغميق الشعر تدريجياً مع مرور الوقت. ومع ذلك، وبسبب سميته، فقد تم تقييد استخدامه في مستحضرات التجميل في العديد من البلدان.
- الكاشف المعملي : يستخدم ككاشف في المختبرات للتفاعلات والتحاليل الكيميائية المختلفة.
- التصوير الفوتوغرافي: في الماضي، استخدم المصورون ثنائي أسيتات الرصاص لحساسية الأفلام الفوتوغرافية والأوراق عند التصوير بالأبيض والأسود.
- سكر الرصاص: تاريخياً، استخدم الناس ثنائي أسيتات الرصاص، المعروف باسم “سكر الرصاص”، لحفظ النبيذ والمشروبات الأخرى.
- الكيمياء التحليلية: في الكيمياء التحليلية، يستخدم العلماء ثنائي أسيتات الرصاص للكشف عن وجود غاز كبريتيد الهيدروجين.
- لاذع في الصباغة : يعمل كمادة لاذعة في صباغة وطباعة المنسوجات.
- التخليق الكيميائي : يعمل كمقدمة لتخليق مركبات الرصاص الأخرى.
على الرغم من استخداماته المختلفة، فمن الضروري توخي الحذر عند استخدام ثنائي أسيتات الرصاص بسبب سميته العالية. تقليل التعرض لمركبات الرصاص واتباع احتياطات السلامة المناسبة بدقة عند التعامل معها والتخلص منها لحماية صحة الإنسان والبيئة. تقييد أو استبدال العديد من تطبيقاتها ببدائل أكثر أمانًا.
أسئلة:
س: هل خلات الرصاص II قابلة للذوبان في الماء؟
ج: ثنائي أسيتات الرصاص II ضعيف الذوبان في الماء.
س: هل خلات الرصاص قابلة للذوبان؟
ج: ثنائي أسيتات الرصاص قليل الذوبان في الماء.
س: ما هي صبغات الشعر التي تحتوي على خلات الرصاص؟
ج: في بعض البلدان، تحتوي بعض صبغات الشعر التقدمية على ثنائي أسيتات الرصاص كمكون، على الرغم من أن استخدامه مقيد بسبب مخاوف تتعلق بالسمية.
س: التعرض المزمن لحمض الخليك يمكن أن يسبب أي مشاكل؟
ج: التعرض المزمن لحمض الأسيتيك يمكن أن يسبب تهيج الجهاز التنفسي والجلد.
س: ما هي صيغة ثنائي أسيتات الرصاص II؟
ج: صيغة ثنائي أسيتات الرصاص II هي Pb(OAc)₂.
س: ما هي خلات الرصاص المستخدمة في محفز ليندلار؟
ج: لا يتم استخدام ثنائي أسيتات الرصاص (II) بشكل عام في محفز Lindlar؛ بدلا من ذلك، يتم استخدام خلات البلاديوم.
س: ما هو خلات الرصاص؟
ج: ثنائي أسيتات الرصاص هو مركب بلوري أبيض يستخدم في تطبيقات مختلفة، مثل صبغات الشعر والتركيب الكيميائي.
س: كيفية صنع خلات الرصاص؟
ج: يمكن تحضير ثنائي أسيتات الرصاص عن طريق تفاعل الرصاص المعدني مع حمض الأسيتيك أو عن طريق طرق التخليق الكيميائي الأخرى.
س: هل توجد صبغات شعر بدون خلات الرصاص؟
ج: نعم، العديد من صبغات الشعر الحديثة لا تحتوي على ثنائي أسيتات الرصاص، حيث تم تقييد استخدامه في مستحضرات التجميل في العديد من البلدان بسبب سميته.
س: هل يحدث تفاعل عند دمج المحاليل المائية من يوديد الألومنيوم وخلات الرصاص الثنائي؟
ج: نعم، يحدث تفاعل ويتكون PbI2 وخلات الألومنيوم كمنتجات.
س: هل يتفاعل كرومات الصوديوم وخلات الرصاص (II)؟
ج: نعم، يحدث تفاعل ينتج عنه تكوين PbCrO4 وخلات الصوديوم.
س: ما المادة الكيميائية التي تتفاعل مع كبريتات النحاس (II) لإنتاج اللون الأزرق ومع خلات الرصاص (II) لإنتاج اللون الأبيض؟
ج: يتفاعل هيدروكسيد الأمونيوم مع كبريتات النحاس الثنائي لتكوين رواسب زرقاء (هيدروكسيد النحاس). في المقابل، يتفاعل كبريتيد الهيدروجين مع ثنائي أسيتات الرصاص (II) لتكوين كبريتيد الرصاص الأبيض.
