أكسيد الليثيوم (Li2O) هو مركب مصنوع من الليثيوم والأكسجين. يُظهر خصائص أيونية قوية ويستخدم على نطاق واسع في البطاريات بسبب إمكاناته الكهروكيميائية العالية.
| اسم الأيوباك | أكسيد الليثيوم |
| الصيغة الجزيئية | Li2O |
| CAS رقم | 12142-77-7 |
| المرادفات | أكسيد الليثيوم (I)؛ أكسيد الديليثيوم. ليثيا. أوكسليثيوم. UNII-06T3K8P3KU |
| إنتشي | InChI=1S/2Li.O |
صيغة أكسيد الليثيوم
صيغة أكسيد الليثيوم
الصيغة الكيميائية لأكسيد الديليثيوم هي Li2O. وهو يمثل مزيجًا من ذرتين من الليثيوم (Li) وذرة أكسجين واحدة (O). هذا المركب البسيط والمستقر ضروري في التطبيقات الصناعية المختلفة.
الكتلة المولية لأكسيد الليثيوم
تبلغ الكتلة المولية لـ Li2O حوالي 29.88 جم / مول. يتم حسابه عن طريق إضافة الكتل الذرية لذرتي الليثيوم (6.94 جم / مول لكل منهما) وذرة أكسجين واحدة (16.00 جم / مول).
نقطة غليان أكسيد الليثيوم
يمتلك أكسيد الديليثيوم نقطة غليان مثيرة للإعجاب تبلغ حوالي 2463 درجة مئوية (4465 درجة فهرنهايت). نقطة الغليان العالية هذه تجعلها مفيدة في الصناعات التي تتطلب مقاومة شديدة للحرارة.
نقطة انصهار أكسيد الليثيوم
تبلغ نقطة انصهار أكسيد الديليثيوم حوالي 1450 درجة مئوية (2642 درجة فهرنهايت). وعندما يتعرض لدرجة الحرارة هذه، فإنه يتغير من الحالة الصلبة إلى الحالة السائلة، مما يسهل عمليات التصنيع المختلفة.
كثافة أكسيد الليثيوم جم/مل
تبلغ كثافة أكسيد الديليثيوم حوالي 2.01 جم / مل. تمثل هذه القيمة كتلة المركب لكل وحدة حجم وهي ضرورية لتحديد خصائصه وتطبيقاته.
الوزن الجزيئي لأكسيد الليثيوم
الوزن الجزيئي لـ Li2O هو 29.88 جم / مول. وهو مجموع الأوزان الذرية للعناصر المكونة له، الليثيوم والأكسجين. هذه القيمة تسهل الحسابات المتكافئة.
هيكل أكسيد الليثيوم
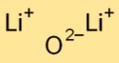
يحتوي أكسيد الديليثيوم على بنية بلورية أيونية بسيطة. وهي مكونة من كاتيونات الليثيوم (Li+) وأنيونات الأكسيد (O2-) متماسكة معًا بواسطة قوى كهروستاتيكية قوية. هذا الترتيب يساهم في استقراره والتوصيل.
ذوبان أكسيد الليثيوم
أكسيد الديليثيوم ذو قابلية منخفضة للذوبان في الماء. يتفاعل مع الماء لتكوين هيدروكسيد الليثيوم، مما يحد من ذوبانه. ومع ذلك، فإنه يظهر بعض الذوبان في بعض المذيبات غير المائية والأملاح المنصهرة.
في الختام، يعد أكسيد الديليثيوم مركبًا مهمًا له خصائص وتطبيقات مختلفة. إن هيكلها المستقر ونقاط الانصهار والغليان العالية تجعلها ذات قيمة في صناعات مثل السيراميك وتصنيع الزجاج وكأحد مكونات البطاريات المتخصصة. إن فهم خصائصه يسمح لنا باستغلال إمكاناته لأغراض مختلفة.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 2.01 جرام/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 29.88 جرام/مول |
| كثافة | 2.01 جرام/مل |
| نقطة الانصهار | 1450 درجة مئوية (2642 درجة فهرنهايت) |
| نقطة الغليان | 2463 درجة مئوية (4465 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل مع الماء |
| الذوبان | ضعف الذوبان في الماء، شكل هيدروكسيد الليثيوم |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
يرجى ملاحظة أن بعض الخصائص مثل نقطة الوميض وضغط البخار وكثافة البخار وpKa وpH غير قابلة للتطبيق أو متاحة لـ Li2O نظرًا لطبيعته الكيميائية وسلوكه.
السلامة ومخاطر أكسيد الليثيوم
يشكل أكسيد الديليثيوم بعض المخاوف والمخاطر المتعلقة بالسلامة. يتفاعل بقوة مع الماء، وينتج هيدروكسيد الليثيوم، وهو مادة كاوية ويمكن أن يسبب تهيج الجلد والعين. استنشاق غبارها أو أبخرتها قد يسبب تهيج الجهاز التنفسي. لا يتم تصنيف المركب على أنه شديد السمية ولكن يجب التعامل معه بحذر لتجنب ملامسته للجلد أو العينين. تعتبر التهوية المناسبة ومعدات الحماية الشخصية ضرورية عند العمل مع أكسيد الديليثيوم. في حالة الابتلاع العرضي، من الضروري الحصول على عناية طبية فورية. بالإضافة إلى ذلك، يجب تخزينه بعيدًا عن المواد غير المتوافقة لتجنب أي خطر محتمل لحدوث حريق أو انفجار.
| رموز الخطر | تآكل |
| وصف الأمان | يتفاعل مع الماء. يسبب تهيج الجلد والعين. التعامل مع الرعاية. تجنب استنشاق الغبار أو الأبخرة. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2825.70.00 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | ثالثا |
| تسمم | ليست سامة للغاية، ولكن الحذر مطلوب. تجنب ابتلاع وملامسة الجلد أو العينين. |
طرق تصنيع أكسيد الليثيوم
طرق مختلفة تسمح بتخليق أكسيد الديليثيوم.
يتضمن النهج الشائع تفاعل معدن الليثيوم مع الأكسجين أو الهواء عند درجات حرارة عالية. في هذه العملية، يسهل غاز الأكسجين تسخين معدن الليثيوم، مما يؤدي إلى تكوين أكسيد الديليثيوم.
هناك طريقة أخرى وهي التحلل الحراري لأملاح الليثيوم، مثل كربونات الليثيوم أو هيدروكسيد الليثيوم ، عند درجات حرارة مرتفعة. وبتعرض هذه الأملاح للحرارة، فإنها تتحلل لتنتج أكسيد الديليثيوم.
بالإضافة إلى ذلك، لإنتاج أكسيد الديليثيوم، يمكن استخدام هيدروكسيد الليثيوم كمقدمة. يتم تجفيفه أولاً بالتسخين، وتحويله إلى شكل الأكسيد المطلوب.
أسلوب آخر ينطوي على استخدام المعادن أو الخامات التي تحتوي على الليثيوم. وتستخرج العمليات الكيميائية مركبات الليثيوم من هذه المصادر الطبيعية، والتي بدورها تخضع لمزيد من المعالجة لإنتاج أكسيد الديليثيوم.
ومن الضروري ملاحظة أن كل طريقة توليف قد يكون لها مزايا وتحديات محددة من حيث التكلفة والكفاءة والنقاء. يأخذ العلماء والمهندسون هذه العوامل في الاعتبار عند اختيار الطريقة الأكثر ملاءمة لإنتاج أكسيد الديليثيوم لتلبية متطلبات صناعية أو بحثية محددة.
استخدامات أكسيد الليثيوم
يجد أكسيد الديليثيوم (Li2O) تطبيقات متعددة الاستخدامات في مختلف الصناعات نظرًا لخصائصه الفريدة. فيما يلي بعض الاستخدامات الرئيسية:
- صناعة السيراميك: يعد أكسيد الديليثيوم مكونًا أساسيًا في صناعة السيراميك، حيث يعمل على تحسين قوتها الميكانيكية وثباتها الحراري. كما أنه يقلل من درجة حرارة الطهي، مما يوفر الطاقة أثناء عملية التصنيع.
- إنتاج الزجاج: في صناعة الزجاج، يعمل أكسيد الديليثيوم كتدفق، مما يخفض درجة حرارة انصهار الزجاج ويحسن مقاومته للهجوم الكيميائي، مما يؤدي إلى منتجات زجاجية عالية الجودة.
- تكنولوجيا البطاريات: يعمل أكسيد الديليثيوم كمقدمة في إنتاج بطاريات الليثيوم أيون. فهو يساهم في المواد الكاثودية للبطارية، وبالتالي تحسين قدرتها على تخزين الطاقة والأداء العام.
- المجفف: إن ارتباط أكسيد الديليثيوم القوي بالماء يجعله مجففًا فعالًا، ويستخدم لإزالة الرطوبة من بيئات معينة، كما هو الحال في أنظمة تكييف الهواء وتنقية الغاز.
- علم المعادن: في العمليات المعدنية، يساعد أكسيد الديليثيوم في تكرير المعادن عن طريق إزالة الشوائب.
- النظارات المتخصصة: إنتاج النظارات المتخصصة لمختلف التطبيقات، مثل البصريات والإلكترونيات والأدوات العلمية، ينطوي على استخدام أكسيد الديليثيوم.
- المحفز: يعمل أكسيد الديليثيوم كمحفز في بعض التفاعلات الكيميائية، مما يسهل تحويل المواد المتفاعلة إلى المنتجات المطلوبة.
- الصناعة النووية: في الصناعة النووية، يعمل أكسيد الديليثيوم كمهدئ للنيوترونات، حيث يتحكم في معدل تفاعلات الانشطار النووي.
يسلط تنوع التطبيقات الضوء على أهمية أكسيد الديليثيوم في تقدم التكنولوجيا والتصنيع والبحث العلمي. تستمر خصائصه الفريدة في دفع الابتكار في مختلف الصناعات، مما يجعله مركبًا قيمًا مع مجموعة واسعة من الاستخدامات العملية.
أسئلة:
س: ما المعادلة التي توضح أن أكسيد الليثيوم يتكون من تفاعل الأكسجين والليثيوم؟
ج: 4Li + O2 → 2Li2O
س: ما هي الكتلة المولية لأكسيد الليثيوم Li2O؟
ج: تبلغ الكتلة المولية لـ Li2O حوالي 29.88 جم/مول.
س: ما هي صيغة أكسيد الليثيوم؟
ج: صيغة أكسيد الديليثيوم هي Li2O.
س: هل أكسيد الليثيوم أيوني أم تساهمي؟
ج: أكسيد الديليثيوم أيوني.
س: ما هو عدد تأكسد الليثيوم في الرابطة الأيونية؟
ج: عدد تأكسد الليثيوم في الرابطة الأيونية هو +1.
س: رقم التنسيق للليثيوم في Li2O؟
ج: رقم التنسيق للليثيوم في Li2O هو 4.
س: هل Li2O أيوني أم تساهمي؟
ج: Li2O أيوني.
س: أي من التفاعلات التالية يرتبط بالطاقة الشبكية لـ Li2O (ΔH°latt)؟
ج: التفاعل: Li+(g) + O2-(g) → Li2O(s)
س: ما هي الكتلة المولية لأكسيد الليثيوم Li2O؟
ج: تبلغ الكتلة المولية لـ Li2O حوالي 29.88 جم/مول.
س: أي مما يلي سوف ينتج عند احتراق معدن الليثيوم (Li)؟ O2، LiO، H2O، Li2O؟
ج: سيتم إنتاج Li2O أثناء احتراق الليثيوم المعدني (Li).
س: كم عدد الجرامات الموجودة في 4.5 مول من Li2O؟
ج: يوجد ما يقرب من 134.46 جرامًا في 4.5 مول من Li2O.
