نترات الرصاص (Pb(NO₃)₂) هي مادة صلبة بلورية بيضاء. وهو قابل للذوبان في الماء ويستخدم بشكل شائع في المختبر لتطبيقات مختلفة، مثل تصنيع مركبات الرصاص الأخرى والألعاب النارية.
| اسم الأيوباك | نترات الرصاص (II). |
| الصيغة الجزيئية | الرصاص (NO₃)₂ |
| CAS رقم | 10099-74-8 |
| المرادفات | نترات الرصاص، ثنائي نترات الرصاص، نترات الرصاص (II)، نترات الرصاص (IV). |
| إنتشي | InChI=1S/2NO3.Pb/c2 2-1(3)4;/q2 -1;+2 |
خصائص نترات الرصاص
صيغة نترات الرصاص
الصيغة الكيميائية لثنائي نترات الرصاص هي Pb(NO₃)₂. يشير هذا إلى أن كل جزيء ثنائي نترات الرصاص يحتوي على ذرة رصاص واحدة (Pb) مرتبطة بأيونات NO₃. هذه الصيغة ضرورية لفهم تكوين وخصائص المركب.
نترات الرصاص الكتلة المولية
يمكن حساب الكتلة المولية لثنائي نترات الرصاص عن طريق إضافة الكتل الذرية للعناصر المكونة له. بالنسبة للرصاص (Pb)، تبلغ الكتلة الذرية حوالي 207.2 جم / مول، وبالنسبة لـ NO₃، تبلغ حوالي 62.0 جم / مول. مجموع هذه القيم يعطي كتلة مولية تبلغ حوالي 331.2 جم / مول لثنائي نترات الرصاص.
درجة غليان نترات الرصاص
نقطة غليان ثنائي نترات الرصاص هي درجة الحرارة التي يتحول عندها من سائل إلى غاز تحت الضغط الجوي القياسي. نقطة غليان ثنائي نترات الرصاص مرتفعة نسبيًا، حوالي 470 درجة مئوية (878 درجة فهرنهايت)، مما يجعلها مناسبة لبعض التطبيقات الصناعية.
نقطة انصهار نترات الرصاص
نقطة انصهار ثنائي نترات الرصاص هي درجة الحرارة التي يتحول عندها من الحالة الصلبة إلى الحالة السائلة. يمتلك ثنائي نترات الرصاص نقطة انصهار تبلغ حوالي 470 درجة مئوية (878 درجة فهرنهايت). تساعد هذه الخاصية في تحديد ظروف التخزين والتعامل المناسبة لها.
كثافة نترات الرصاص جم/مل
كثافة نترات الرصاص هي مقياس لكتلتها لكل وحدة حجم. تبلغ كثافة ثنائي نترات الرصاص حوالي 4.53 جم / مل. وهذه الكثافة العالية تجعله مادة ثقيلة وتدخل في مختلف العمليات الصناعية والمخبرية.
الوزن الجزيئي لنترات الرصاص
يبلغ الوزن الجزيئي لثنائي نترات الرصاص، والذي يُسمى أيضًا الكتلة المولية، حوالي 331.2 جم/مول. هذه القيمة حاسمة في الحسابات المتكافئة ولتحديد كمية المادة في عينة معينة.
هيكل نترات الرصاص
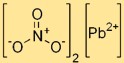
ثنائي نترات الرصاص له بنية بلورية في شكله الصلب. كاتيونات Pb²⁺ محاطة بأنيونات NO₃⁻ في ترتيب ثلاثي الأبعاد. يمنح هذا الهيكل الشبكي البلوري نترات الرصاص ثباته وخصائصه المميزة.
ذوبان نترات الرصاص
نترات الرصاص شديدة الذوبان في الماء. يذوب بسهولة في الماء ليشكل محلول شفاف عديم اللون. تعد قابلية ذوبان ثنائي نترات الرصاص ضرورية في العديد من التطبيقات، كما هو الحال في التفاعلات الكيميائية وكمقدمة في تخليق مركبات الرصاص الأخرى. تعد المعالجة والتخلص المناسبين أمرًا بالغ الأهمية نظرًا لقابليته للذوبان وتأثيراته البيئية المحتملة.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 4.53 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 331.2 جرام/مول |
| كثافة | 4.53 جم/مل |
| نقطة الانصهار | 470 درجة مئوية (878 درجة فهرنهايت) |
| نقطة الغليان | ~470 درجة مئوية (~878 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء، قابل للذوبان بشكل طفيف في الكحول الإيثيلي |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | محايد (حوالي 7) |
سلامة ومخاطر نترات الرصاص
يشكل ثاني نترات الرصاص العديد من المخاطر المتعلقة بالسلامة. الاتصال المباشر مع المركب قد يؤدي إلى تهيج الجلد والعينين. استنشاق غبار أو أبخرة ثنائي نترات الرصاص قد يسبب مشاكل في الجهاز التنفسي. وبسبب قابليته للذوبان في الماء، فإنه يمكن أن يلوث مصادر المياه ويضر بالحياة المائية. بالإضافة إلى ذلك، تكون مركبات الرصاص سامة عند تناولها، ويمكن أن يؤدي التعرض للرصاص إلى التسمم بالرصاص. لتقليل المخاطر، ينبغي اتخاذ تدابير السلامة المناسبة عند التعامل مع نترات الرصاص، مثل استخدام معدات الحماية، والعمل في منطقة جيدة التهوية، واتباع المبادئ التوجيهية المعمول بها للتخزين. التعامل والتخلص. ومن الضروري توخي الحذر لتجنب الآثار الصحية الضارة والتلوث البيئي.
| رموز الخطر | خطر على الصحة، مسبب للتآكل، مهيج |
| وصف الأمان | مهيج. تجنب الاتصال المباشر. استخدم معدات الوقاية الشخصية. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 1469 (نترات الرصاص) |
| رمز النظام المنسق | 2834.29.1000 |
| فئة الخطر | 5.1 (عامل مؤكسد) |
| مجموعة التعبئة | ثانيا |
| تسمم | سام إذا تم ابتلاعه أو استنشاقه. |
طرق تصنيع نترات الرصاص
هناك عدة طرق لتصنيع ثنائي نترات الرصاص، تتضمن جميعها تفاعل مركبات الرصاص مع حمض النيتريك.
الطريقة الشائعة هي خلط أكسيد الرصاص (PbO) أو كربونات الرصاص (PbCO₃) مع حمض النيتريك المركز (HNO₃). وينتج عن التفاعل ثنائي نترات الرصاص والماء. تتضمن الطريقة الأخرى إذابة الرصاص المعدني أو أكسيد الرصاص في حمض النيتريك المخفف، مما يؤدي إلى تكوين ثنائي نترات الرصاص.
تتضمن الطريقة الثانية التفاعل بين Pb(OAc)₂ ونترات الصوديوم . في هذا الأسلوب، قم بإذابة Pb(OAc)₂ في الماء، ثم أضف نترات الصوديوم إلى المحلول. يؤدي التفاعل بين هذين المركبين إلى تكوين ثنائي نترات الرصاص وخلات الصوديوم.
يجب على الكيميائي إذابة الرصاص المعدني أو أكسيد الرصاص في حمض النيتريك المخفف الساخن لتصنيع ثنائي نترات الرصاص في المختبر. يجب عليهم التحكم بعناية في التفاعل لتجنب توليد حرارة وأبخرة زائدة. بمجرد اكتمال التفاعل، تتم عادة تنقية محلول ثنائي نترات الرصاص عن طريق الترشيح أو التبلور.
ومن الأهمية بمكان إدارة عملية التوليف بعناية بسبب سمية مركبات الرصاص. ولضمان سلامتهم، يجب عليهم استخدام التهوية الكافية وارتداء معدات الحماية الشخصية المناسبة (PPE). بالإضافة إلى ذلك، يجب عليهم التخلص من جميع النفايات بشكل صحيح لتجنب تلوث البيئة.
استخدامات نترات الرصاص
يجد ثنائي نترات الرصاص تطبيقات مختلفة في صناعات مختلفة نظرًا لخصائصه الفريدة. بعض الاستخدامات الرئيسية لثنائي نترات الرصاص تشمل:
- منتجات الألعاب النارية: يستخدم المصنعون عادة ثنائي نترات الرصاص لتعزيز سطوع وألوان شاشات الألعاب النارية لأنه يعمل كعامل مؤكسد.
- صناعة الأصباغ والأصباغ: إن إنتاج بعض الأصباغ والأصباغ التي تحتوي على الرصاص، مثل أصباغ الكروم الصفراء والبرتقالية، ينطوي على استخدام ثنائي نترات الرصاص كمادة خام.
- المثبت الحراري: تستخدم صناعة البلاستيك ثنائي نترات الرصاص كمثبت حراري للـ PVC (كلوريد البوليفينيل) لمنع التدهور الحراري أثناء المعالجة والاستخدام.
- أعواد الثقاب: تحتوي رؤوس أعواد الثقاب على نترات الرصاص لتعزيز الالتهاب عند ضربها بسطح خشن.
- الطلاء الكهربائي: تشتمل حمامات الطلاء الكهربائي على ثنائي نترات الرصاص كمكون أساسي لتسهيل ترسيب طلاءات الرصاص على الأسطح المختلفة.
- الكيمياء التحليلية: تستخدم المختبرات ثنائي نترات الرصاص ككاشف لإجراء اختبارات وتحليلات كيميائية محددة.
- مانع التآكل: تستخدم بعض التركيبات ثنائي نترات الرصاص كمثبط لتآكل المعادن، مما يحميها من الأكسدة والتحلل.
- المستحضرات الصيدلانية: تستخدم صناعة المستحضرات الصيدلانية أحيانًا ثنائي نترات الرصاص ككاشف في عمليات تصنيع محددة.
أسئلة:
س: هل نترات الرصاص قابلة للذوبان؟
ج: نعم، نترات الرصاص تذوب في الماء.
س: يتم إضافة الفضة المعدنية إلى محلول نترات الرصاص (2). ما هو التفاعل الكيميائي المتوازن؟
ج: التفاعل الكيميائي المتوازن: 2Ag + Pb(NO₃)₂ → 2AgNO₃ + Pb.
س: هل نترات الرصاص II إلكتروليت؟
ج: نعم، ثنائي نترات الرصاص (II) هو إلكتروليت.
س: ما النسبة المئوية لكتلة الرصاص في نترات الرصاص (2) (pb(no3)2) مقربة إلى ثلاثة أرقام معنوية؟
ج: تبلغ نسبة كتلة الرصاص في Pb(NO₃)₂ حوالي 73.5%.
س: ماذا يحدث عند تسخين نترات الرصاص؟
ج: عند تسخين نترات الرصاص تتحلل لتنتج أكسيد الرصاص وثاني أكسيد النيتروجين وغاز الأكسجين.
س: هل نترات الرصاص قابلة للذوبان في الماء؟
ج: نعم، نترات الرصاص شديدة الذوبان في الماء.
س: ما الغازان اللذان ينطلقان عند تسخين نترات الرصاص؟
ج: الغازان المنطلقان هما ثاني أكسيد النيتروجين (NO₂) والأكسجين (O₂).
س: ماذا تلاحظ عند تسخين نترات الرصاص؟
ج: عندما يتم تسخين ثنائي نترات الرصاص، فإنه يتحلل، ويطلق أبخرة ثاني أكسيد النيتروجين البني وبقايا صفراء من أكسيد الرصاص.
س: ما هو الغاز الذي ينطلق عند تسخين نترات الرصاص؟
ج: ينطلق غاز ثاني أكسيد النيتروجين (NO₂) عند تسخين نترات الرصاص.
س: ماذا سيحدث إذا جمعنا محلول يوديد الصوديوم مع محلول نترات الرصاص (2)؟
ج: عندما يتم دمج محاليل يوديد الصوديوم وثنائي نترات الرصاص (II)، يتكون راسب أصفر من يوديد الرصاص (PbI₂).
