بيكربونات الأمونيوم هو مركب بلوري أبيض يستخدم في الخبز كعامل ترك. يطلق ثاني أكسيد الكربون عند تسخينه، مما يؤدي إلى الحصول على مخبوزات خفيفة ورقيقة.
| اسم الأيوباك | بيكربونات الأمونيوم |
| الصيغة الجزيئية | NH4HCO3 |
| CAS رقم | 1066-33-7 |
| المرادفات | كربونات الأمونيوم الحمضية؛ أمونيا المخابز ملح الأمونيوم من حمض الكربونيك (1:1)؛ كربونات هيدروجين الأمونيوم |
| إنتشي | إنتشي = 1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
يرجى ملاحظة أن قيمة InChI المقدمة هي تمثيل مبسط وقد لا تكون كاملة.
خصائص بيكربونات الأمونيوم
صيغة بيكربونات الأمونيوم
الصيغة الكيميائية لبيكربونات الأمونيوم هي NH4HCO3. ويتكون من أيون الأمونيوم (NH4+) وأيون البيكربونات (HCO3-). تمثل هذه الصيغة تركيبة المركب، مما يدل على وجود مجموعات الأمونيوم والبيكربونات.
الكتلة المولية لبيكربونات الأمونيوم
يتم حساب الكتلة المولية لكربونات هيدروجين الأمونيوم عن طريق إضافة الكتل الذرية للعناصر المكونة لها. بالنسبة لكربونات هيدروجين الأمونيوم (NH4HCO3)، تبلغ الكتلة المولية حوالي 79.06 جرامًا لكل مول. هذه القيمة مهمة لمختلف الحسابات والتحويلات الكيميائية.
درجة غليان بيكربونات الأمونيوم
لا تحتوي كربونات هيدروجين الأمونيوم على نقطة غليان مميزة لأنها تتحلل إلى منتجات غازية عند تسخينها. ومع ذلك، تبدأ عملية التحلل عند حوالي 60 إلى 70 درجة مئوية. ومع ارتفاع درجة الحرارة، يتحلل المركب إلى الأمونيا (NH3)، والماء (H2O)، وثاني أكسيد الكربون (CO2).
نقطة انصهار بيكربونات الأمونيوم
تبلغ درجة انصهار كربونات هيدروجين الأمونيوم حوالي 41 إلى 60 درجة مئوية. عند تسخينه، يخضع المركب للتسامي، وينتقل مباشرة من الحالة الصلبة إلى الحالة الغازية دون المرور عبر الطور السائل.
كثافة بيكربونات الأمونيوم جم/مل
تبلغ كثافة كربونات هيدروجين الأمونيوم حوالي 1.59 جرام لكل مليلتر (جم / مل) في درجة حرارة الغرفة. تمثل هذه القيمة كتلة المركب لكل وحدة حجم. تؤثر كثافة كربونات هيدروجين الأمونيوم على سلوكها في التطبيقات المختلفة وعلى قابليتها للذوبان في المذيبات المختلفة.
الوزن الجزيئي لبيكربونات الأمونيوم
يبلغ الوزن الجزيئي لكربونات هيدروجين الأمونيوم حوالي 79.06 جرامًا لكل مول. يتم الحصول على هذه القيمة عن طريق إضافة الكتل الذرية للعناصر الموجودة في المركب (النيتروجين والهيدروجين والكربون والأكسجين). الوزن الجزيئي ضروري لحساب كمية كربونات هيدروجين الأمونيوم اللازمة للتفاعلات الكيميائية.
هيكل بيكربونات الأمونيوم
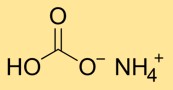
تحتوي كربونات هيدروجين الأمونيوم على بنية بلورية تتكون من أيونات الأمونيوم (NH4+) والبيكربونات (HCO3-). يتكون أيون الأمونيوم من اتحاد ذرة نيتروجين واحدة وأربع ذرات هيدروجين، بينما يتكون أيون البيكربونات من ذرة كربون واحدة مرتبطة بثلاث ذرات أكسجين.
ذوبان بيكربونات الأمونيوم
كربونات هيدروجين الأمونيوم شديدة الذوبان في الماء. يذوب بسهولة في المحاليل المائية، ويطلق أيونات الأمونيوم وأيونات البيكربونات. ومع ذلك، فإن ذوبانه يتناقص مع درجة الحرارة. وهو قابل للذوبان بشكل سيئ في الكحول وغير قابل للذوبان في معظم المذيبات العضوية.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 1,586 جم/سم3 |
| لون | عديم اللون |
| يشم | رائحة الأمونيا |
| الكتلة المولية | 79.06 جم/مول |
| كثافة | 1.59 جم/مل |
| نقطة الانصهار | 41-60 درجة مئوية |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | يذوب في الماء؛ ضعيف الذوبان في الكحول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | ~7 |
يرجى ملاحظة أن القيم المقدمة تقريبية وقد تختلف حسب عوامل مثل النقاء والظروف البيئية.
سلامة ومخاطر بيكربونات الأمونيوم
تقدم كربونات هيدروجين الأمونيوم بعض اعتبارات السلامة والمخاطر. قد يهيج العينين والجلد والجهاز التنفسي عن طريق الاتصال أو الاستنشاق. التعرض المباشر قد يسبب عدم الراحة، بما في ذلك الإحساس بالحرقان. من المهم التعامل مع المركب بعناية واستخدام معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية. بالإضافة إلى ذلك، يمكن لكربونات هيدروجين الأمونيوم أن تطلق غاز الأمونيا الضار عند تسخينها، لذا فإن التهوية الكافية ضرورية في مثل هذه المواقف. المركب غير قابل للاشتعال وليس له نقطة اشتعال محددة. يعد التخزين السليم ووضع العلامات والالتزام ببروتوكولات السلامة أمرًا ضروريًا لتقليل المخاطر المرتبطة بمعالجة واستخدام كربونات هيدروجين الأمونيوم.
| رموز الخطر | شي (مزعج) |
| وصف الأمان | – تجنب ملامسة العينين والجلد والاستنشاق.\n- استخدم معدات الحماية الشخصية المناسبة.\n- تأكد من التهوية الكافية عند التعامل.\n- قم بالتخزين بشكل صحيح ووضع ملصقات على الحاويات.\n – اتبع بروتوكولات السلامة. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 28369990 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير مصنف |
| تسمم | سمية منخفضة. مهيجة للعيون والجلد والجهاز التنفسي. |
يرجى ملاحظة أن المعلومات المقدمة عامة بطبيعتها وقد لا تغطي جميع جوانب سلامة ومخاطر كربونات هيدروجين الأمونيوم. من المهم الرجوع إلى أوراق ولوائح بيانات السلامة المحددة للحصول على إرشادات كاملة.
طرق تصنيع بيكربونات الأمونيوم
هناك عدة طرق لتجميع كربونات هيدروجين الأمونيوم.
تتضمن الطريقة الشائعة التفاعل بين الأمونيا الغازية (NH3) وثاني أكسيد الكربون (CO2) في محلول مائي. في هذه العملية، تقوم بسكب الغازين مباشرة في الماء ويشكل الماء محلول كربونات هيدروجين الأمونيوم. ثم تقوم بتركيز المحلول وبلورته للحصول على المركب الصلب.
هناك طريقة أخرى وهي التفاعل بين الأمونيا وثاني أكسيد الكربون في مذيب، مثل الميثانول أو الإيثانول. ويحدث التفاعل تحت ضغط ودرجة حرارة عالية، مما يؤدي إلى تكوين بلورات كربونات هيدروجين الأمونيوم.
معالجة كربونات الأمونيوم بثاني أكسيد الكربون تنتج بيكربونات الأمونيوم والماء. تتفاعل كربونات الأمونيوم ، سواء كانت في حالتها الصلبة أو في محلول، مع ثاني أكسيد الكربون لإنتاج بيكربونات الأمونيوم.
لتجميع كربونات هيدروجين الأمونيوم، يمكن دمج الأمونيا مع حمض الكربونيك. يتكون حمض الكربونيك عن طريق إذابة ثاني أكسيد الكربون في الماء، وإضافة الأمونيا إلى محلول حمض الكربونيك الناتج ينتج كربونات هيدروجين الأمونيوم.
تأكد من أن تخليق كربونات هيدروجين الأمونيوم يتم في منطقة جيدة التهوية بسبب إطلاق غاز الأمونيا أثناء التفاعلات. اتبع احتياطات السلامة المناسبة وبروتوكولات المناولة لضمان عملية تركيب آمنة وفعالة.
استخدامات بيكربونات الأمونيوم
تجد كربونات هيدروجين الأمونيوم استخدامات مختلفة في الصناعات والتطبيقات المختلفة. فيما يلي بعض استخداماته الشائعة:
- الخبز: يتم استخدام كربونات هيدروجين الأمونيوم كعامل ترك في الخبز، خاصة بالنسبة لملفات تعريف الارتباط والمقرمشات وغيرها من السلع المخبوزة. يطلق ثاني أكسيد الكربون عند تسخينه، مما يخلق ملمسًا خفيفًا ومقرمشًا.
- إنتاج الأمونيا: تعمل كربونات هيدروجين الأمونيوم كمركب وسيط في إنتاج الأمونيا. يمكن أن يتحلل إلى الأمونيا وثاني أكسيد الكربون، ويمكن بعد ذلك فصلهما واستخدامهما لأغراض مختلفة.
- الزراعة: يستخدمه المزارعون كمصدر للنيتروجين في الأسمدة لتوفير العناصر الغذائية الأساسية لنمو النبات. تمتصه النباتات بسهولة بفضل قابليته للذوبان في الماء.
- التحكم في الرقم الهيدروجيني: تستخدم الصناعات كربونات هيدروجين الأمونيوم لضبط مستويات الرقم الهيدروجيني في عمليات مثل معالجة المياه وتصنيع الأصباغ وإنتاج الأصباغ.
- طفايات الحريق: تستخدم بعض طفايات الحريق ذات البودرة الجافة هذا المركب كطفاية حريق. فهو يخمد اللهب ويعطل عملية الاحتراق.
- عامل التنظيف: تستخدمه بعض الصناعات كعامل تنظيف لإزالة الأوساخ والشحوم والملوثات من الأسطح.
- صناعة النسيج والجلود: في عمليات الصباغة والطباعة للمنسوجات والسلع الجلدية، تساعد كربونات هيدروجين الأمونيوم على تثبيت الأصباغ وتحسين ثبات اللون.
- التطبيقات الصيدلانية: يتم تطبيقه في بعض المستحضرات الصيدلانية كعامل منظم أو مكون في الأقراص الطبية.
تسلط التطبيقات المتنوعة لكربونات هيدروجين الأمونيوم الضوء على تنوعها وفائدتها عبر العديد من الصناعات، بما في ذلك الخبز والزراعة والتحكم في درجة الحموضة وإخماد الحرائق وعمليات التصنيع المختلفة.
أسئلة:
س: هل بيكربونات الأمونيوم سيئة بالنسبة لك؟
ج: قد تكون كربونات هيدروجين الأمونيوم ضارة إذا تم تناولها أو استنشاقها بكميات كبيرة، مما يسبب تهيجًا للجهاز التنفسي والجلد. وينبغي التعامل معها واستخدامها مع الاحتياطات المناسبة.
س: كيفية فصل كربونات الأمونيوم عن بيكربونات الأمونيوم؟
ج: يمكن فصل كربونات الأمونيوم عن كربونات هيدروجين الأمونيوم عن طريق تسخين الخليط، لأن بيكربونات الأمونيوم تتحلل إلى أمونيا وثاني أكسيد الكربون وماء، تاركة وراءها كربونات الأمونيوم.
س: كيف يتم حساب الرقم الهيدروجيني لبيكربونات الأمونيوم في الماء؟
ج: يمكن حساب الرقم الهيدروجيني لكربونات هيدروجين الأمونيوم في الماء باستخدام معادلة هندرسون-هاسلبالش: pH = pKa + log([A-]/[HA])، حيث pKa هو ثابت تفكك الحمض و[A-]/[ HA] يمثل نسبة القاعدة المترافقة إلى الحمض.
س: كيف يمكنني ضبط الرقم الهيدروجيني لمحلول بيكربونات الأمونيوم؟
ج: يمكن تعديل الرقم الهيدروجيني لمحلول كربونات هيدروجين الأمونيوم المنظم بإضافة إما حمض قوي لخفض الرقم الهيدروجيني أو قاعدة قوية لزيادة الرقم الهيدروجيني مع الحفاظ على النسبة المناسبة من بيكربونات الأمونيوم إلى قاعدته المترافقة.
س: هل بيكربونات الأمونيوم آمنة في الطعام؟
ج: من المعروف بشكل عام أن كربونات هيدروجين الأمونيوم آمنة للاستخدام في الأطعمة، ولكن يجب استخدامها وفقًا للمبادئ التوجيهية التنظيمية وبكميات مناسبة.
س: ما هو عازلة بيكربونات الأمونيوم؟
ج: محلول كربونات هيدروجين الأمونيوم هو محلول يحتوي على كربونات هيدروجين الأمونيوم وقاعدته المترافقة (أو حمضه)، ويستخدم للحفاظ على درجة حموضة ثابتة في مختلف التطبيقات البيوكيميائية والبيولوجية.
س: ما هي الكتلة الجزيئية لبيكربونات الأمونيوم؟
ج: تبلغ الكتلة الجزيئية لكربونات هيدروجين الأمونيوم حوالي 79.06 جم/مول.
س: ما النسبة المئوية للتركيب الكتلي للهيدروجين في NH4HCO3؟
ج: تبلغ نسبة كتلة الهيدروجين في NH4HCO3 حوالي 6.57%.
س: هل NH4HCO3 حمض أم قاعدة؟
ج: يمكن أن يعمل NH4HCO3 كحمض وقاعدة معًا، اعتمادًا على السياق. يمكنها التبرع ببروتون (H+) ليكون بمثابة حمض أو قبول بروتون ليكون بمثابة قاعدة.
س: ما اسم المركب الذي صيغته NH4HCO3؟
ج: المركب الذي له الصيغة NH4HCO3 يسمى كربونات هيدروجين الأمونيوم.
س: هل NH4HCO3 أيوني أم تساهمي؟
ج: يعتبر NH4HCO3 مركبا أيونيا لوجود أيون الأمونيوم (NH4+) وأيون كربونات الهيدروجين (HCO3-) في تركيبه.
