حمض الهيدرازويك (HN3) مركب شديد التطاير. إنه عديم اللون وله رائحة نفاذة. يتم استخدامه في التفاعلات الكيميائية ويمكن أن يكون سامًا ومتفجّرًا.
| اسم الأيوباك | حمض الهيدرازويك |
| الصيغة الجزيئية | HN3 |
| CAS رقم | 7782-79-8 |
| المرادفات | أزويميد، أزيد الهيدروجين، حمض الآزوتيك، حمض الهيدرونيتريك، حمض التريازويك |
| إنتشي | إنتشي = 1S/HN3/c1-3-2/h1H |
خصائص حمض الهيدرازويك
صيغة حمض الهيدرازويك
الصيغة الكيميائية لحمض الهيدرازويك هي HN3. وتتكون من ذرة هيدروجين واحدة وثلاث ذرات نيتروجين مرتبطة ببعضها البعض بشكل تساهمي. تمثل هذه الصيغة البسيطة التركيب الأساسي للمركب، وهو أمر بالغ الأهمية لفهم خصائصه وتفاعلاته.
الكتلة المولية لحمض الهيدرازويك
تبلغ الكتلة المولية لأزيد الهيدروجين (HN3) حوالي 43.03 جرامًا لكل مول. يتم الحصول على هذه القيمة عن طريق إضافة الكتل الذرية لذرة هيدروجين واحدة (H) وثلاث ذرات نيتروجين (N). الكتلة المولية ضرورية لحساب قياس العناصر الكيميائية في التفاعلات الكيميائية.
نقطة غليان حمض الهيدرازويك
أزيد الهيدروجين لديه نقطة غليان منخفضة نسبيًا، حوالي 37 درجة مئوية (98.6 درجة فهرنهايت). بسبب طبيعته المتطايرة، فإنه يتبخر بسهولة إلى شكل غازي عند درجات حرارة معتدلة. مطلوب الحذر الشديد عند التعامل مع هذا المركب.
نقطة انصهار حمض الهيدرازويك
تبلغ نقطة انصهار أزيد الهيدروجين حوالي -80 درجة مئوية (-112 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول المركب الصلب إلى الحالة السائلة. كونها شديدة التفاعل، فإن حالتها الصلبة تتطلب التخزين والتعامل المناسبين.
كثافة حمض الهيدرازويك جم/مل
تبلغ كثافة أزيد الهيدروجين حوالي 1.09 جرام لكل ملليلتر. تشير هذه القيمة إلى كتلته لكل وحدة حجم، مما يعكس تماسكه وتركيزه في مساحة معينة. إنها معلمة حاسمة للقياسات المختبرية.
الوزن الجزيئي لحمض الهيدرازويك
الوزن الجزيئي لأزيد الهيدروجين (HN3) هو 43.03 جرام لكل مول. هو مجموع الأوزان الذرية للعناصر الموجودة في جزيء واحد من المركب. يلعب الوزن الجزيئي دورًا حيويًا في تحديد سلوكه الفيزيائي والكيميائي.
هيكل حمض الهيدرازويك
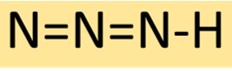
أزيد الهيدروجين له بنية جزيئية خطية، تتكون من ثلاث ذرات نيتروجين مرتبطة بالتسلسل مع ذرة هيدروجين واحدة في النهاية. وينتج عن هذا الترتيب مركب مستقر ولكنه شديد التفاعل، وغالبًا ما يستخدم في التركيب الكيميائي.
ذوبان حمض الهيدرازويك
أزيد الهيدروجين ذو قابلية محدودة للذوبان في الماء، مما يجعله مركبًا ضعيف الذوبان. يمكن أن يذوب إلى حد ما في المحاليل المائية، لكن ذوبانه المنخفض يحد من استخدامه في بعض التطبيقات. هناك حاجة إلى رعاية خاصة عند التعامل مع شكله المائي بسبب طبيعته السامة والمتفجرة.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1.09 جرام/مل |
| لون | عديم اللون |
| يشم | رائحة نفاذة |
| الكتلة المولية | 43.03 جم/مول |
| كثافة | 1.09 جرام/مل |
| نقطة الانصهار | -80 درجة مئوية (-112 درجة فهرنهايت) |
| نقطة الغليان | 37 درجة مئوية (98.6 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان قليلا |
| الذوبان | قابل للذوبان في المذيبات القلوية والعضوية مثل الكحول والأثير |
| ضغط البخار | 23.1 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | 1.4 (الهواء = 1) |
| pKa | 4.6 |
| الرقم الهيدروجيني | حوالي 3-4 |
سلامة ومخاطر حمض الهيدرازويك
يشكل أزيد الهيدروجين مخاطر كبيرة على السلامة. وهو شديد السمية ويمكن أن يسبب آثارًا صحية خطيرة إذا تعرض له. استنشاق الأبخرة أو الضباب يمكن أن يسبب تهيج الجهاز التنفسي، والدوخة، وحتى الموت. قد يؤدي ملامسة الجلد أو العينين إلى حدوث حروق وتهيج وتلف الأنسجة. المركب أيضًا قابل للاشتعال للغاية ويمكن أن يشكل مخاليط متفجرة. يتفاعل بعنف مع المواد المختلفة، مثل المعادن والعوامل المؤكسدة. وينبغي اتباع تدابير السلامة المناسبة عند التعامل مع أزيد الهيدروجين، بما في ذلك ارتداء الملابس الواقية، واستخدام التهوية الكافية، وتخزينه بشكل آمن لتجنب الحوادث أو الإطلاقات في البيئة. البيئة.
| رموز الخطر | الجمجمة والعظمتين المتقاطعتين، قابلة للتآكل |
| وصف الأمان | سامة للغاية ومسببة للتآكل |
| أرقام تعريف الأمم المتحدة | UN1687 |
| رمز النظام المنسق | 2811.29.10 |
| فئة الخطر | 6.1 (المواد السامة) |
| مجموعة التعبئة | الثاني (خطر متوسط) |
| تسمم | سام جدا؛ يمكن أن تكون قاتلة بكميات صغيرة |
طرق تصنيع حمض الهيدرازويك
طرق مختلفة تسمح بتخليق أزيد الهيدروجين.
يتضمن النهج الشائع التفاعل بين أزيد الصوديوم (NaN3) وحمض، مثل حمض الكبريتيك (H2SO4) أو حمض الهيدروكلوريك (HCl) . في هذه الطريقة، يختلط الحمض مع أزيد الصوديوم، مما يؤدي إلى تكوين أزيد الهيدروجين والملح المقابل للحمض المستخدم.
تتضمن الطريقة الأخرى التفاعل بين أزيد الصوديوم وهاليد الألكيل، مثل يوديد الميثيل (CH3I) أو يوديد الإيثيل (C2H5I). يؤدي هذا التفاعل، المعروف باسم إعادة ترتيب كورتيوس، إلى تكوين أزيد الهيدروجين كمنتج.
التفاعل بين أزيد الصوديوم وحمض النيتروز (HNO2) ينتج أزيد الهيدروجين. لتوليد حمض النيتروز في الموقع، عادة ما يتم إضافة نتريت الصوديوم (NaNO2) إلى محلول حمضي. التفاعل بين أزيد الصوديوم وحمض النيتروز ينتج أزيد الهيدروجين.
ومن المهم أن نلاحظ أن تخليق أزيد الهيدروجين يتطلب معالجة دقيقة وتدابير السلامة المناسبة. ونظرًا لسميته وطبيعته المتفجرة، ينبغي إجراء التفاعلات في منطقة جيدة التهوية، باستخدام معدات الحماية المناسبة واتباع البروتوكولات المعمول بها.
كل طريقة توليف لها مزاياها وقيودها، ويعتمد اختيار الطريقة على عوامل مثل توافر الكاشف، والعائد المطلوب، واعتبارات السلامة. يعد الفهم الجيد والخبرة في التعامل مع المواد الكيميائية الخطرة أمرًا ضروريًا لإجراء هذه التوليفات بكفاءة وأمان.
استخدامات حمض الهيدرازويك
يجد أزيد الهيدروجين تطبيقات في مختلف المجالات بسبب خصائصه الفريدة. وهذه بعض استخداماته:
- الكاشف الكيميائي: يعمل أزيد الهيدروجين ككاشف كيميائي متعدد الاستخدامات في التخليق العضوي، ويشارك بنشاط في العديد من التفاعلات، بما في ذلك تخليق الأزيدات، التي تعتبر لبنات بناء أساسية في المستحضرات الصيدلانية والأصباغ.
- الصواعق والوقود: يستخدم المصنعون أزيد الهيدروجين لإنتاج الصواعق والوقود المستخدم في الوسائد الهوائية وأجهزة الأمان، مستفيدين من طبيعته المتفجرة وتحلله السريع، الذي يطلق غاز النيتروجين بشكل فعال، مما يجعله ذا قيمة في هذه التطبيقات.
- التحليل المختبري: تستخدم الكيمياء التحليلية أزيد الهيدروجين للكشف النشط وتحديد العناصر والمركبات المختلفة. فهو يشكل بشكل فعال مجمعات تحتوي على معادن محددة، مما يسمح بتقديرها الكمي عن طريق قياس الألوان أو طرق المعايرة.
- أبحاث الكيمياء الحيوية: في أبحاث الكيمياء الحيوية، يستخدم العلماء بنشاط أزيد الهيدروجين لتعديل الجزيئات الحيوية ودراسة وظائفها. يتفاعل بشكل انتقائي مع مجموعات وظيفية معينة، وبالتالي يساهم بشكل فعال في تحديد وتوصيف الجزيئات البيولوجية.
- التصوير الفوتوغرافي: في التصوير الفوتوغرافي التقليدي بالأبيض والأسود، يعمل أزيد الهيدروجين بشكل فعال كمحسس في المستحلبات، مما يحسن حساسية الضوء للأفلام الفوتوغرافية ويؤدي بشكل فعال إلى تحسين جودة الصورة.
- مثبط التآكل: تستخدم الصناعات بنشاط أزيد الهيدروجين كمثبط لتآكل المعادن، وخاصة النحاس وسبائكه. إنه يشكل طبقة واقية على السطح المعدني، ويمنع التآكل ويطيل عمر الخدمة لمختلف المعدات والهياكل.
- مولدات الغاز: يلعب أزيد الهيدروجين دورًا نشطًا في مولدات الغاز للوسائد الهوائية وأنظمة الإنقاذ. يؤدي تحلله السريع إلى إطلاق غاز النيتروجين بشكل فعال، مما يوفر القوة اللازمة للتضخم والانتشار.
أسئلة:
س: هل حمض الهيدرازويك مادة كاوية؟
ج: نعم، يعتبر حمض الهيدرازويك مادة كاوية ويمكن أن يسبب حروقًا وتلف الأنسجة عند ملامسته.
س: هل حمض الهيدرازويك حمض قوي؟
ج: نعم، حمض الهيدرازويك يصنف على أنه حمض قوي، قادر على التأين الكامل في الماء لإطلاق أيونات الهيدرونيوم.
س: هل حمض الهيدرازويك حمض ثلاثي؟
ج: لا، حمض الهيدرازويك ليس حمضًا ثلاثيًا. تحتوي الأحماض الثلاثية على ثلاثة عناصر مختلفة (الهيدروجين والأكسجين وعنصر ثالث)، بينما يحتوي حمض الهيدرازويك فقط على الهيدروجين والنيتروجين والأكسجين.
س: كم مل من حمض الهيدرازويك لكل 12.5 مل؟
ج: يبدو السؤال غير كامل ويتطلب معلومات إضافية للحصول على إجابة دقيقة.
س: ما هو تركيب لويس الصحيح لحمض الهيدرازويك (HN3)، بما في ذلك الشحنات الرسمية، إن وجدت؟
ج: يتكون تركيب لويس الصحيح لـ HN3 من ذرة نيتروجين مركزية مرتبطة بثلاث ذرات نيتروجين أخرى وذرة هيدروجين واحدة. يمكن تحديد الرسوم الرسمية على أساس الاختلافات في السالبية الكهربية.
س: كيف يؤثر حمض الهيدرازويك على السيتوكروم سي أوكسيديز؟
ج: يثبط أزيد الهيدروجين أوكسيديز السيتوكروم سي، وهو إنزيم يشارك في التنفس الخلوي، عن طريق الارتباط بموقعه النشط وتعطيل وظيفته.
س: ما هو Ka لحمض الهيدرازويك إذا كان حمض الهيدرازويك 0.20 م له درجة حموضة 3.21؟
ج: يمكن حساب Ka لحمض الهيدرازويك باستخدام الرقم الهيدروجيني والمعادلة Ka = [H3O+][A-]/[HA]. هناك حاجة إلى مزيد من المعلومات لتحديد قيمة Ka.
س: ما هي حالة أكسدة النيتروجين في حمض الهيدرازويك (HN3)؟
ج: حالة أكسدة النيتروجين في حمض الهيدرازويك هي -1.
س: ما هو الرقم الهيدروجيني لمحلول 0.15 مولاري من HN3 إذا كان Ka = 1.8 × 10^-9؟
ج: يمكن حساب الرقم الهيدروجيني لمحلول مولاري 0.15 من HN3 باستخدام قيمة Ka والمعادلة pH = -log10(sqrt(Ka × [HA])).
س: كيفية موازنة N2 + H2 في HN3؟
ج: المعادلة المتوازنة للتفاعل N2 + H2 → HN3 ستكون 3N2 + 6H2 → 2HN3.
س: كيف يتم حساب Ka لـ HN3؟
ج: يمكن حساب Ka من HN3 باستخدام تركيز التوازن للمنتجات والمواد المتفاعلة في تفاعل تفكك HN3.
س: ما مولارية NaN3 إذا كانت مولارية HN3 تساوي 0.012 م؟
ج: لا يمكن تحديد مولية NaN3 بدون معلومات إضافية أو معادلة موزونة للتفاعل بين NaN3 وHN3.
س: ما هو تركيب لويس الصحيح لحمض الهيدرازويك (HN3)، بما في ذلك الشحنات الرسمية، إن وجدت؟
ج: يتضمن تركيب لويس الصحيح لـ HN3 ذرة نيتروجين مركزية مرتبطة بثلاث ذرات نيتروجين أخرى وذرة هيدروجين واحدة. يمكن تحديد الرسوم الرسمية على أساس الاختلافات في السالبية الكهربية.
