نترات الحديد الثالث مركب كيميائي. ويتكون من اتحاد أيونات الحديد مع أيونات النترات. يستخدم عادة في التطبيقات الصناعية وككاشف مختبري.
| اسم الأيوباك | نترات الحديد (III). |
| الصيغة الجزيئية | الحديد (NO3)3 |
| CAS رقم | 10421-48-4 |
| المرادفات | نترات الحديديك، ثلاثي نترات الحديد، ملح الحديد (III) لحمض النيتريك |
| إنتشي | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
خواص نترات الحديد (III).
صيغة نترات الحديد (III).
صيغة نترات الحديد III هي Fe(NO3)3. ويتكون من أيون حديد واحد (Fe) وثلاثة أيونات نترات (NO3). تمثل هذه الصيغة مزيج كاتيون الحديد مع أنيونات النترات.
نترات الحديد الثلاثي الكتلة المولية
يمكن حساب الكتلة المولية لنترات الحديد عن طريق إضافة الكتل الذرية للعناصر المكونة لها. يمتلك الحديد (Fe) كتلة مولية تبلغ 55.845 جم/مول، بينما تبلغ الكتلة المولية لكل أيون نترات (NO3) 62.0049 جم/مول. وبإضافة هذه القيم نحصل على كتلة مولية تبلغ حوالي 241.86 جم/مول لنترات الحديد.
درجة غليان نترات الحديد (III).
نترات الحديد ليس لها نقطة غليان محددة. عند تسخينه، فإنه يتحلل إلى أكاسيد النيتروجين المختلفة ويشكل في النهاية أكسيد الحديد. وتعتمد درجة حرارة التحلل على عوامل مثل التركيز ووجود مواد أخرى.
نقطة انصهار نترات الحديد (III).
تبلغ نقطة انصهار نترات الحديد حوالي 47 درجة مئوية (117 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول المركب الصلب إلى الحالة السائلة. من المهم ملاحظة أن نقطة الانصهار يمكن أن تختلف قليلاً اعتمادًا على عوامل مثل الشوائب أو التركيب الدقيق للمركب.
كثافة نترات الحديد (III) جم/مل
تبلغ كثافة Fe(NO3)3 حوالي 1.68 جم/مل. تمثل الكثافة الكتلة لكل وحدة حجم من المادة. في هذه الحالة، يشير إلى كتلة Fe(NO3)3 لكل ملليلتر من المركب.
الحديد (III) الوزن الجزيئي
يبلغ الوزن الجزيئي لنترات الحديد حوالي 241.86 جم / مول. يشير الوزن الجزيئي إلى مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء.
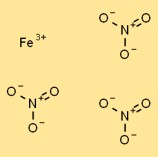
هيكل نترات الحديد (III).
نترات الحديد لها بنية بلورية في شكلها الصلب. وهو يتكون من كاتيونات Fe3+ محاطة بأنيونات النترات المنسقة (NO3-). ترتبط كاتيونات الحديد معًا بواسطة روابط أيونية، بينما تنجذب أنيونات النترات إلى الكاتيونات بواسطة القوى الكهروستاتيكية.
ذوبان نترات الحديد (III).
نترات الحديد شديدة الذوبان في الماء. يذوب بسهولة في الماء ليشكل محلول أصفر شاحب واضح. قد تختلف قابلية ذوبان نترات الحديد في المذيبات أو المواد الأخرى.
| مظهر | بلورات صفراء شاحبة |
| جاذبية معينة | 1.68 |
| لون | أصفر شاحب |
| يشم | عديم الرائحة |
| الكتلة المولية | 241.86 جم/مول |
| كثافة | 1.68 جرام/مل |
| نقطة الانصهار | 47 درجة مئوية (117 درجة فهرنهايت) |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والمذيبات القطبية |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | حامض |
سلامة ومخاطر نترات الحديد (III).
تشكل نترات الحديد بعض مخاطر السلامة ويجب توخي الحذر عند التعامل معها. يعتبر مهيجاً للجلد والعينين والجهاز التنفسي. يجب تجنب الاتصال المباشر بالمركب ويجب ارتداء معدات الحماية مثل القفازات والنظارات الواقية. إن تناول أو استنشاق نترات الحديد قد يسبب تأثيرات ضارة ولذلك لا ينبغي تناولها أو استنشاقها. من المهم العمل مع هذا المركب في منطقة جيدة التهوية لتقليل مخاطر الاستنشاق. في حالة التعرض العرضي أو الابتلاع، يجب طلب العناية الطبية الفورية. يجب اتباع ممارسات التخزين والتعامل المناسبة لضمان السلامة.
| رموز الخطر | شي، أو |
| وصف الأمان | يسبب تهيج الجلد والعين. قد يسبب تهيج الجهاز التنفسي. ضارة إذا ابتلعت. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 1466 (لا مائي) |
| رمز النظام المنسق | 28342990 |
| فئة الخطر | 5.1 (عامل مؤكسد) |
| مجموعة التعبئة | ثانيا |
| تسمم | سمية معتدلة |
طرق تصنيع نترات الحديد (III).
يمكن تصنيع نترات الحديد بطرق مختلفة، الطريقة الشائعة هي إذابة أكسيد الحديد (III) (Fe2O3) في حمض النيتريك المركز (HNO3). وينتج عن هذا التفاعل تكوين نترات الحديد، ممثلة بالمعادلة:
يذيب حمض النيتريك المركز أكسيد الحديد (III) وينتج الحديد (NO3)3 بالإضافة إلى إنتاج الماء:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
هناك طريقة أخرى تتضمن دمج الحديد المعدني مع خليط من حمض النيتريك وبيروكسيد الهيدروجين، الذي يعمل على أكسدة الحديد لتكوين نترات الحديد. يستحق رد الفعل المعروف هذا اسم طريقة “أكوا ريجيا”.
تؤدي إضافة الحديد المعدني إلى خليط حمض النيتريك وبيروكسيد الهيدروجين إلى إنتاج نترات الحديد والماء:
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
ومن الأهمية بمكان توخي الحذر عند إجراء هذه التفاعلات بسبب الطبيعة المسببة للتآكل والأكسدة للمواد الكيميائية المعنية. ومن الضروري اتباع تدابير السلامة المناسبة، مثل ارتداء معدات الحماية والعمل في منطقة جيدة التهوية.
يقدم موردو المواد الكيميائية ذوي السمعة الطيبة نترات الحديد المتاحة تجاريًا، مما يضمن مصدرًا ثابتًا وموثوقًا للمركب لمختلف التطبيقات في الصناعات والمختبرات.
استخدامات نترات الحديد (III).
لنترات الحديد العديد من الاستخدامات العملية في مختلف الصناعات والمختبرات. وفيما يلي بعض التطبيقات الرئيسية لنترات الحديد:
- المحفز الصناعي: العديد من العمليات الصناعية، بما في ذلك إنتاج النايلون والبوليمرات الأخرى، تستخدم نترات الحديد كمحفز.
- الصباغة والأصباغ: تستخدم صناعة الصباغة والصبغ نترات الحديد كمادة مثبتة لتثبيت الأصباغ على الأقمشة وتحسين ثبات اللون.
- النقش: تستخدم صناعات تشغيل المعادن والإلكترونيات نترات الحديد كأداة نقش لإنشاء أنماط وتصميمات معقدة على الأسطح المعدنية.
- الكاشف المختبري: تعمل نترات الحديد ككاشف مختبري شائع لمختلف التفاعلات والتجارب الكيميائية، وخاصة لتخليق المركبات الأخرى.
- العامل المؤكسد: تعمل نترات الحديد كعامل مؤكسد في التفاعلات الكيميائية، بما في ذلك التخليق العضوي، وذلك بسبب خصائصها المؤكسدة القوية.
- معالجة المياه: نترات الحديد مفيدة في عمليات معالجة المياه لإزالة الشوائب، مثل الفوسفات والكبريتيدات، من مياه الصرف الصناعي.
- التصوير الفوتوغرافي: تستخدم بعض عمليات التصوير الفوتوغرافي، وأبرزها تحضير المستحلبات الفوتوغرافية ذات الأساس الحديدي، نترات الحديد.
- الكيمياء التحليلية: تجد نترات الحديد تطبيقات في تقنيات الكيمياء التحليلية، مثل التحليل اللوني، لاكتشاف وقياس مواد معينة.
- الحفاظ على الخشب: تستخدم معالجات المواد الحافظة للخشب نترات الحديد كعنصر نشط لحماية الخشب من التعفن الفطري وتفشي الحشرات.
- التطبيقات الصيدلانية: تركيب بعض المنتجات الصيدلانية والأدوية ينطوي على استخدام نترات الحديد.
من المهم ملاحظة أنه يجب اتباع احتياطات التعامل والسلامة المناسبة عند العمل مع نترات الحديد نظرًا لطبيعتها المسببة للتآكل والأكسدة.
أسئلة:
س: هل نترات الحديد (III) قابلة للاشتعال؟
ج: لا، نترات الحديد غير قابلة للاشتعال.
س: ما هي المخاوف المتعلقة بالسلامة والتعامل مع نترات الحديد (III)؟
ج: تشمل المخاوف المتعلقة بالسلامة تهيج الجلد والعينين والجهاز التنفسي. ولذلك يجب التعامل معها بمعدات الحماية والاحتياطات المناسبة.
س: ما الصيغة التي تمثل نترات الحديد (III)؟
ج: صيغة نترات الحديد هي Fe(NO3)3.
س: ما هي صيغة نترات الحديد (III)؟
ج: صيغة نترات الحديد (III) هي Fe(NO3)3.
س: ما هي الكتلة المولية لنترات الحديد (III)؟
ج: تبلغ الكتلة المولية لـ Fe(NO3)3 حوالي 241.86 جم/مول.
س: هل هيدروكسيد الحديد يذوب في الماء؟
ج: هيدروكسيد الحديد قليل الذوبان في الماء.
س: هل يتفاعل مع نترات الحديد (III)؟
ج: لا، الكالسيوم (Ca) لا يتفاعل عمومًا مع Fe(NO3)3.
س: ما هو الجزء من الأسبرين الذي تتفاعل معه نترات الحديد (III)؟
ج: تتفاعل نترات الحديد (III) مع مجموعة الكربوكسيل (-COO-) الموجودة في جزيء الأسبرين.
س: ما هي الكتلة الجزيئية لنترات الحديد (III)؟
ج: تبلغ الكتلة الجزيئية لـ Fe(NO3)3 حوالي 241.86 جم/مول.
س: هل يتفاعل Al مع نترات الحديد (III)؟
ج: نعم، يمكن أن يتفاعل الألومنيوم (Al) مع Fe(NO3)3 لتكوين نترات الألومنيوم والحديد المعدني.
س: ما عدد مولات النترات المذابة في 50.0 جم من الماء في محلول نترات الحديد الثلاثي تركيزه 3.80 م؟
ج: لتحديد مولات النترات، من الضروري تحديد حجم المحلول، حيث يتم توفير المولارية وكتلة الماء فقط.
