4-إيثيلفينول أو C8H10O مركب كيميائي ذو رائحة حلوة وحارة وعشبية، يستخدم في العطور والنكهات وكمبيد للفطريات في الزراعة. يمكن أن يكون أيضًا نتيجة ثانوية لفساد النبيذ.
| اسم الأيوباك | 4-إيثيلفينول |
| الصيغة الجزيئية | C8H10O |
| CAS رقم | 104-96-7 |
| المرادفات | ب-إيثيلفينول، 4-هيدروكسي إيثيل بنزين، 4-EHP |
| إنتشي | إنتشي = 1S/C8H10O/c1-7-3-2-6-4-8(7)5-9/h2-5.9H.6H2.1H3 |
الصيغة 4-إيثيلفينول
صيغة 4-إيثيلفينول هي C8H10O. تعطي الصيغة عدد الذرات الموجودة في الجزيء وأنواعها، وتستخدم لحساب كتلته المولية ووزنه الجزيئي وخصائص أخرى.
C8H10O الرنين المغناطيسي النووي
يتيح التحليل الطيفي بالرنين المغناطيسي النووي (NMR) للعلماء دراسة بنية الجزيئات وتكوينها. من خلال تحليل طيف الرنين المغناطيسي النووي C8H10O لـ 4-إيثيلفينول، يمكنهم تحديد التحولات الكيميائية، وثوابت الاقتران، وشدة الذروة التي تكشف معلومات حول بنية وتكوين الجزيء.
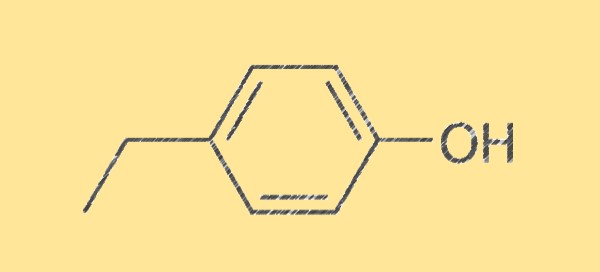
هيكل 4-إيثيلفينول C8H10O
يتميز هيكل 4-إيثيلفينول بصيغته الجزيئية C8H10O، المكونة من ثماني ذرات كربون وعشر ذرات هيدروجين وذرة أكسجين واحدة. وهو سائل عديم اللون ذو رائحة حلوة وحارة وعشبية. الجزيء متماثل ويحتوي على مجموعة الهيدروكسيل (-OH) المرتبطة بذرة الكربون، مما يجعله الفينول.
الكتلة المولية لـ 4-إيثيلفينول
الكتلة المولية لـ 4-إيثيلفينول هي 134.17 جم / مول. يتم تعريف الكتلة المولية على أنها كتلة المادة التي تحتوي على مول واحد من الكيانات، مثل الذرات أو الجزيئات أو الأيونات. ويتم حسابه عن طريق إضافة الكتل الذرية لجميع العناصر الموجودة في الجزيء. في حالة 4-إيثيلفينول، فإن صيغته الجزيئية (C8H10O) تعطينا الكتلة المولية البالغة 134.17 جم/مول.
نقطة غليان 4-إيثيلفينول
درجة غليان 4-إيثيلفينول هي 218.7 درجة مئوية. نقطة غليان المادة هي درجة الحرارة التي يتساوى عندها ضغط بخارها مع الضغط الجوي ويتحول السائل إلى بخار. نقطة غليان 4-إيثيلفينول مرتفعة نسبيًا بسبب قوى الجذب بين الجزيئات الموجودة في الجزيء.
نقطة انصهار 4-إيثيلفينول
نقطة انصهار 4-إيثيلفينول هي 9.7 درجة مئوية. نقطة انصهار المادة هي درجة الحرارة التي تتحول عندها من الحالة الصلبة إلى الحالة السائلة. نقطة انصهار 4-إيثيلفينول منخفضة نسبيًا بسبب وزنه الجزيئي المنخفض ونقص القوى الجزيئية القوية.
كثافة 4-إيثيلفينول جم/مل
تبلغ كثافة 4-إيثيلفينول 1.02 جم / مل. يتم تعريف كثافة المادة على أنها كتلتها لكل وحدة حجم. ويتم حسابه عن طريق قسمة كتلة عينة المادة على حجمها. كثافة 4-إيثيلفينول منخفضة نسبيًا بسبب وزنه الجزيئي المنخفض ونقص القوى الجزيئية القوية.
الوزن الجزيئي لـ 4-إيثيلفينول
الوزن الجزيئي لـ 4-إيثيلفينول هو 134.17 جم / مول. الوزن الجزيئي هو نفس الكتلة المولية ويتم حسابه عن طريق إضافة الكتل الذرية لجميع العناصر الموجودة في الجزيء. في حالة 4-إيثيلفينول، فإن صيغته الجزيئية (C8H10O) تعطينا الوزن الجزيئي 134.17 جم/مول.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1.02 جرام/مل |
| لون | عديم اللون |
| يشم | رائحة حلوة وحارة وعشبية |
| الكتلة المولية | 134.17 جرام/مول |
| كثافة | 1.02 جرام/مل |
| نقطة الانصهار | 9.7 درجة مئوية |
| نقطة الغليان | 218.7 درجة مئوية |
| نقطة فلاش | 100 درجة مئوية |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في المذيبات العضوية |
| ضغط البخار | 32 ملم زئبق (20 درجة مئوية) |
| كثافة بخار | 2.4 (الهواء = 1) |
| pKa | 9.5 |
| الرقم الهيدروجيني | حيادي |
سلامة ومخاطر 4-إيثيلفينول
يخزن 4-إيثيلفينول بعيدا عن مصادر الحرارة والاشتعال لأنه سائل قابل للاشتعال. الاتصال المباشر قد يسبب تهيج الجلد والعين، كما أن استنشاق أبخرته أو رذاذه قد يسبب تهيج الجهاز التنفسي. احمِ نفسك بارتداء قفازات واقية ونظارات أمان وجهاز تنفس عند التعامل مع 4-إيثيلفينول. تعامل معه بعناية وتخلص منه بشكل صحيح وفقًا للوائح المحلية.
| رموز الخطر | سائل قابل للاشتعال، مهيج |
| وصف الأمان | S2: يُحفظ بعيدًا عن متناول الأطفال؛ S24/25: تجنب ملامسة الجلد والعينين؛ S36/37/39: ارتد الملابس الواقية المناسبة والقفازات وأدوات حماية العين/الوجه. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1993، سائل قابل للاشتعال، NOS (4-إيثيلفينول) |
| رمز النظام المنسق | 2909.30.90 |
| فئة الخطر | 3 |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 عن طريق الفم (الجرذ) = 5400 ملغم/كغم. قد يسبب تهيج الجلد والعين. قد يؤدي استنشاق أبخرةه أو رذاذه إلى تهيج الجهاز التنفسي. |
طرق تخليق 4-إيثيلفينول
4-يتم تصنيع الإيثيلفينول من تفاعل الفينول مع أكسيد الإيثيلين في وجود عامل حفاز قلوي مثل هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم. يحدث التفاعل عند درجة حرارة 60-80 درجة مئوية وعند الضغط الجوي. تختلف النسبة المولية للفينول إلى أكسيد الإيثيلين من 1:1 إلى 1:2، اعتمادًا على المحصول المطلوب ونقاء 4-إيثيلفينول. يتم بعد ذلك تحييد خليط التفاعل وتقطيره للحصول على المنتج المطلوب.
تشتمل طريقة التخليق البديلة على تفاعل 4-كلورو-أو-كريسول مع أكسيد الإيثيلين في وجود محفز قلوي، مثل هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم. يحدث التفاعل عند درجة حرارة 60-80 درجة مئوية وعند الضغط الجوي. تختلف النسبة المولية لـ 4-كلورو-أو-كريسول إلى أكسيد الإيثيلين من 1:1 إلى 1:2، اعتمادًا على المحصول المطلوب ونقاء 4-إيثيلفينول. يتم بعد ذلك تحييد خليط التفاعل وتقطيره للحصول على المنتج المطلوب.
من المهم ملاحظة أن كلا الطريقتين تتطلب تحكمًا دقيقًا في درجة الحرارة والضغط وتركيز المحفز لتحقيق العائد والنقاء المطلوب لـ 4-إيثيلفينول. يجب أيضًا مراقبة خليط التفاعل بعناية للتأكد من وجود شوائب، مثل منتجات التفاعل الثانوية أو الملوثات من المواد الخام، لضمان جودة المنتج النهائي.
استخدامات 4-إيثيلفينول
تستخدم الصناعات على نطاق واسع 4-إيثيلفينول كمكون عطري في منتجات العناية الشخصية والمنتجات المنزلية مثل العطور والصابون والمنظفات والشموع بسبب رائحته العشبية الحلوة والحارة. تستخدم صناعة المواد الغذائية 4-إيثيلفينول كعامل نكهة في الحلوى والمخبوزات والمشروبات الكحولية. كمقدمة، فإنه ينتج أيضًا مركبات أخرى، مثل p-cresol، للصناعات الدوائية والكيميائيات الدقيقة.
يستخدم المصنعون 4-إيثيلفينول في إنتاج الراتنجات والملدنات والبوليمرات الأخرى، وكذلك في تصنيع المطاط والعطور الاصطناعية. يدرس الباحثون أيضًا إمكاناته كعامل مضاد للفطريات بسبب آثاره المثبطة على نمو الفطريات.
تنظم الهيئات التنظيمية مثل الاتحاد الأوروبي وإدارة الغذاء والدواء الأمريكية والرابطة الدولية للعطور استخدام 4-إيثيلفينول لضمان استخدامه الآمن والمسؤول. يتطلب الاستخدام الآمن لـ 4-إيثيلفينول دراسة متأنية لآثاره الصحية والبيئية المحتملة، بالإضافة إلى التعامل معه وتخزينه بشكل سليم.
أسئلة:
ما هي إيثيلفينول؟
إيثيلفينول هي مجموعة من المركبات العضوية التي تحتوي على مجموعة الفينول الوظيفية ومجموعة إيثيل (-C2H5) المرتبطة بحلقة الفينول. يتم تصنيفها على أنها كحولات عطرية ولها خصائص فيزيائية وكيميائية مختلفة اعتمادًا على موقع مجموعة الإيثيل على حلقة الفينول. تشمل الأمثلة الشائعة للإيثيلفينول 4-إيثيلفينول و2-إيثيلفينول. ولهذه المركبات استخدامات مختلفة في صناعات العطور والمواد الغذائية والصناعات الكيماوية، وكذلك في تركيب مواد كيميائية أخرى. ومع ذلك، يتم تنظيم استخدام إيثيلفينول بسبب المخاوف بشأن آثارها الصحية والبيئية المحتملة، ويتطلب استخدامها الآمن دراسة متأنية لمتطلبات التعامل معها وتخزينها.
ما هو تركيب المركب الذي تصفه البيانات الطيفية أدناه؟ الصيغة c8h10o
لا يمكن للبيانات الطيفية وحدها أن تحدد بشكل قاطع بنية المركب، ولكنها يمكن أن توفر معلومات لتحديد هويته. تشير الصيغة C8H10O إلى أن المركب عبارة عن كحول عطري، وهو ما يمكن تأكيده من خلال وجود مجموعة كحول وظيفية، يشار إليها بذروة OH في طيف الأشعة تحت الحمراء.
يمكن أن يوفر طيف الرنين المغناطيسي النووي 1H معلومات حول عدد ونوع ذرات الهيدروجين في الجزيء، مثل وجود الهيدروجين العطري والهيدروجين الأليفاتي، بالإضافة إلى أي مجموعات وظيفية. يمكن أن يوفر طيف الرنين المغناطيسي النووي 13C أيضًا معلومات حول نوع ذرات الكربون الموجودة في الجزيء وبيئتها.
بناءً على هذه المعلومات، من الممكن استنتاج بنية المركب، ولكن ستكون هناك حاجة إلى معلومات وتحليلات إضافية لتأكيدها بشكل نهائي. يمكن أن تشتمل بعض الهياكل المحتملة لمركب له الصيغة C8H10O على الفينول، أو الكريسول، أو الزيلينول، من بين أشياء أخرى.
ما رأيك في بنية طيف الرنين المغناطيسي النووي الذي تمثله الصيغة الكيميائية c8h10o؟
يمكنك تحديد البنية المحتملة للجزيء بالصيغة الكيميائية C8H10O في صورة كحول عطري. من المتوقع أن ترى إشارة فردية أو مزدوجة لبروتون الهيدروكسيل وعدة قمم لإشارة البروتون العطرية في طيف الرنين المغناطيسي النووي 1H. في طيف الرنين المغناطيسي النووي 13C، ترى إشارات لكربونات الحلقة العطرية ومجموعة الكربونيل.
هناك عدة عوامل مثل البيئة، والمذيبات، وتركيز الجزيء، وكذلك الشوائب أو الأيزومرات، يمكن أن تؤثر على أطياف الرنين المغناطيسي النووي. لتحديد بنية الجزيء بشكل نهائي، يجب عليك تحليل وتفسير طيف الرنين المغناطيسي النووي الفعلي، على الرغم من أنه يمكنك إجراء تنبؤ بناءً على الصيغة الكيميائية.
كيفية حساب درجات عدم التشبع لـ c8h10o؟
يمكن حساب درجات عدم تشبع الجزيء باستخدام الصيغة:
درجات عدم التشبع = (2 + عدد الحلقات) + (عدد الروابط المزدوجة / 2)
يحتوي الجزيء ذو الصيغة C8H10O على حلقة واحدة فقط لأنه حلقة عطرية. لا يحتوي الجزيء على روابط مزدوجة لأنه كحول ولا يحتوي على روابط مزدوجة.
لذلك، سيتم حساب درجات عدم التشبع لـ C8H10O على النحو التالي:
درجات عدم التشبع = (2 + 1) + (0/2) = 3
تشير هذه النتيجة إلى أن جزيء C8H10O له ثلاث درجات من عدم التشبع، وبالتالي من المحتمل أن يكون كحولًا عطريًا. يوفر حساب درجات عدم التشبع طريقة سريعة ومريحة لتقدير التركيب الجزيئي للمركب وتحديد ما إذا كان يحتوي على مجموعات أو حلقات وظيفية غير مشبعة. ومع ذلك، تجدر الإشارة إلى أن هذا الأسلوب له بعض القيود وغير مناسب لجميع المركبات.
ما هو c8h10o؟
C8H10O هي الصيغة الكيميائية لجزيء يحتوي على 8 ذرات كربون و10 ذرات هيدروجين وذرة أكسجين واحدة. يمكن أن يكون الجزيء واحدًا من العديد من المركبات الكيميائية المختلفة، بما في ذلك الكحولات العطرية مثل الفينول، أو الكريسول، أو الزيلينول، وغيرها.
تحدد تقنيات مثل التحليل الطيفي للأشعة تحت الحمراء أو التحليل الطيفي بالرنين المغناطيسي النووي أو قياس الطيف الكتلي الهوية الحقيقية للجزيء بناءً على تركيبه الجزيئي وخصائصه.
