2-بنتانول مركب عضوي له الصيغة الجزيئية C5H12O. وهو سائل عديم اللون يستخدم كمذيب وفي إنتاج الأدوية والعطور.
| اسم الأيوباك | 2-بنتانول |
| الصيغة الجزيئية | C5H12O |
| CAS رقم | 6032-29-7 |
| المرادفات | كحول الأميل، كحول الأميل الجاف، كحول بنتيل 2 |
| إنتشي | إنتشي = 1S/C5H12O/c1-3-4-5(2)6/h5-6H,3-4H2,1-2H3 |
خصائص 2-بنتانول
2- تركيبة البنتانول
صيغة 2-بنتانول هي C5H12O. وهو يمثل التركيب الجزيئي لهذا المركب العضوي. ويتكون من خمس ذرات كربون واثنتي عشرة ذرة هيدروجين وذرة أكسجين واحدة.
2- البنتانول الكتلة المولية
يتم حساب الكتلة المولية لكحول 2-بنتيل عن طريق إضافة الكتل الذرية للعناصر المكونة له. مع صيغة C5H12O، تبلغ كتلته المولية حوالي 88.15 جرامًا لكل مول. الكتلة المولية أمر بالغ الأهمية لمختلف الحسابات والتحويلات الكيميائية.
درجة غليان 2-بنتانول
نقطة غليان كحول 2-بنتيل هي درجة الحرارة التي يتحول عندها من سائل إلى غاز تحت الضغط الجوي القياسي. درجة غليانها منخفضة نسبيًا، حوالي 118 درجة مئوية (244 درجة فهرنهايت). هذه الخاصية تجعلها مفيدة في العمليات الصناعية المختلفة.
2- نقطة انصهار البنتانول
تشير نقطة انصهار كحول 2-بنتيل إلى درجة الحرارة التي يتغير عندها من الحالة الصلبة إلى الحالة السائلة. تبلغ نقطة انصهارها حوالي -79 درجة مئوية (-110 درجة فهرنهايت). هذه الخاصية تسمح لها بالوجود في شكل سائل في درجة حرارة الغرفة.
كثافة 2-بنتانول جم/مل
كثافة كحول 2-بنتيل هي مقياس لكتلته لكل وحدة حجم. تبلغ كثافته حوالي 0.81 جرام لكل مليلتر (جم / مل). هذه الخاصية مهمة في تحديد قابلية الذوبان والسلوك الفيزيائي للمركب.
2- الوزن الجزيئي للبنتانول
الوزن الجزيئي لكحول 2-بنتيل هو مجموع الأوزان الذرية لجميع الذرات الموجودة في صيغته. هذا حوالي 88.15 جرامًا لكل مول. يوفر الوزن الجزيئي نظرة ثاقبة لكتلة المركب ويساعد في الحسابات الكيميائية المختلفة.
هيكل 2-بنتانول
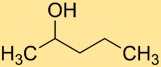
يتكون هيكل كحول 2-بنتيل من سلسلة من خمس ذرات كربون مرتبطة ببعضها البعض، مع مجموعة هيدروكسيل (-OH) متصلة بذرة الكربون الثانية. يمنح هيكل الكحول الأولي هذا المركب خصائص كيميائية فريدة وتفاعلية.
ذوبان 2-بنتانول
2- كحول البنتيل ذو قابلية متوسطة للذوبان في الماء، بسبب قدرته على تكوين روابط هيدروجينية. وهو أكثر قابلية للذوبان في المذيبات القطبية مثل الإيثانول والأسيتون. ومع ذلك، فإن قابليته للذوبان تتناقص مع زيادة طول سلسلة الكربون في المذيبات غير القطبية.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.812 جم/مل |
| لون | عديم اللون |
| يشم | رائحة مميزة |
| الكتلة المولية | 88.15 جرام/مول |
| كثافة | 0.812 جم/مل |
| نقطة الانصهار | -79 درجة مئوية |
| نقطة الغليان | 118 درجة مئوية |
| نقطة فلاش | 34 درجة مئوية |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في المذيبات القطبية مثل الإيثانول والأسيتون |
| ضغط البخار | 5.15 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 3.03 (الهواء = 1) |
| pKa | 16.0 |
| الرقم الهيدروجيني | حوالي 7 |
سلامة ومخاطر 2-بنتانول
2-يثير كحول البنتيل بعض الاعتبارات المتعلقة بالسلامة والمخاطر. من المهم التعامل مع هذا المركب بعناية. استنشاق أبخرةه قد يسبب تهيج الجهاز التنفسي. الاتصال المباشر مع الجلد أو العينين قد يسبب تهيجًا وعدم الراحة. يُنصح باستخدام معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند العمل باستخدام كحول 2 بنتيل. هذا المركب قابل للاشتعال ويجب حفظه بعيدًا عن اللهب المكشوف أو مصادر الاشتعال. في حالة الابتلاع أو التعرض العرضي، يوصى باستشارة الطبيب. من الضروري تخزين ومعالجة كحول البنتيل 2 في منطقة جيدة التهوية واتباع بروتوكولات السلامة المناسبة.
| رموز الخطر | Xn (ضار) |
| وصف الأمان | تجنب الاستنشاق، وارتداء معدات الحماية |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1105 |
| رمز النظام المنسق | 2905.16.00 |
| فئة الخطر | 3 |
| مجموعة التعبئة | ثالثا |
| تسمم | ضار إذا ابتلع أو استنشق |
طرق تصنيع 2-بنتانول
هناك عدة طرق لتصنيع كحول 2 بنتيل. النهج الشائع هو تفاعل الأكسدة الهيدروبورية. في هذه الطريقة، يخضع 1-بنتين، وهو ألكين، لعملية المعالجة المائية مع البوران لتكوين ألكوكسيد البورون المقابل. مزيد من الأكسدة باستخدام بيروكسيد الهيدروجين أو هيبوكلوريت الصوديوم يحول ألكوكسيد البورون إلى كحول 2 بنتيل.
هناك طريقة أخرى تتضمن ترطيب 1-بنتين. في هذه العملية، يتفاعل 1-بنتين مع الماء في وجود محفز حمضي مثل حمض الكبريتيك أو حمض الفوسفوريك. يتم التفاعل بإضافة ماركوفنيكوف، مما يؤدي إلى تكوين كحول 2-بنتيل.
لتصنيع كحول 2-بنتيل، يمكن اختزال البنتانال، وهو ألدهيد، باستخدام عوامل اختزال مثل بوروهيدريد الصوديوم أو هيدريد ألومنيوم الليثيوم. يحول التفاعل البنتانال إلى كحول 2 بنتيل.
يسمح تفاعل غرينيارد بتحضير كحول 2 بنتيل. تفاعل كاشف غرينيارد، مثل بروميد ميثيل المغنسيوم، مع الفورمالديهايد (أو مشتقاته) يولد ألكوكسيد المغنيسيوم الوسيط. المعالجة الحمضية للعائدات الوسيطة تنتج 2- كحول بنتيل.
التخمير هو طريقة أخرى للحصول على كحول 2 بنتيل. يمكن لبعض الكائنات الحية الدقيقة، مثل الخميرة، تحويل السكريات من الكتلة الحيوية إلى كحول 2 بنتيل من خلال سلسلة من التفاعلات الأنزيمية.
توفر طرق التوليف هذه طرقًا مختلفة لإنتاج كحول 2-بنتيل، مما يوفر المرونة للتطبيقات الصناعية ويضمن إمدادًا ثابتًا بهذا المركب القيم.
استخدامات 2-بنتانول
2- للكحول البنتيل تطبيقات عديدة كمذيب في العديد من الصناعات بما في ذلك الأدوية ومستحضرات التجميل والعطور.
- يتم استخدامه كمادة كيميائية وسيطة في إنتاج الملدنات والنكهات والمركبات الصيدلانية.
- 2- يستخدم كحول البنتيل كمادة خام لتركيب مركبات أخرى مثل الاسترات عن طريق تفاعله مع الأحماض.
- يتم استخدامه كمعدل لزوجة في منتجات العناية الشخصية وكعامل ترطيب في الطلاء والدهانات.
- 2- يستخدم كحول البنتيل كمذيب للراتنجات والزيوت والشموع نظرا لقدرته على إذابة مجموعة واسعة من المواد.
- إنه بمثابة مادة خام لتصنيع المنظفات والمستحلبات والمواد الخافضة للتوتر السطحي.
- يستخدم هذا المركب كمادة منكهة في الأطعمة والمشروبات، ويضيف نكهة الفواكه والزهور إلى المنتج النهائي.
- 2- يستخدم كحول البنتيل في إنتاج المواد الكيميائية الزراعية مثل مبيدات الأعشاب والمبيدات الحشرية.
- وهو يعمل ككاشف كيميائي في التركيب العضوي، مما يسهل التحولات الكيميائية المختلفة.
- 2- كما يستخدم كحول البنتيل في المختبر كمذيب لعمليات الاستخلاص والتنقية.
أسئلة:
س: ما هي وظيفة المحفز الحمضي في تعزيز جفاف 2-بنتانول؟
ج: يسهل المحفز الحمضي إزالة جزيء الماء من كحول 2-بنتيل، مما يعزز تفاعل الجفاف وتكوين الألكين المقابل.
س: كيف يتم تحضير 2-بنتانول بتفاعل جرينارد؟
ج: لتصنيع كحول 2-بنتيل باستخدام تفاعل جرينارد، قم بتفاعل كاشف جرينارد، مثل بروميد الميثيل مغنيسيوم، مع الفورمالديهايد أو مشتقاته، متبوعًا بالمعالجة الحمضية لإنتاج كحول 2-بنتيل.
س: ما هو الطيف الكتلي لـ 2-بنتانول؟
ج: يعرض الطيف الكتلي لكحول 2-بنتيل توزيع أيوناته وشظاياه الجزيئية، مما يوفر معلومات حول وزنه الجزيئي وخصائصه الهيكلية.
