1- البنتانول هو كحول سائل عديم اللون يحتوي على خمس ذرات كربون. يتم استخدامه كمذيب ووسيط في التركيب الكيميائي وله تطبيقات صناعية مختلفة.
| اسم الأيوباك | البنتان-1-ol |
| الصيغة الجزيئية | C₅H₁₁OH |
| CAS رقم | 71-41-0 |
| المرادفات | كحول الأميل، كحول ن-أميل، 1-هيدروكسي بنتان، كحول ن-بنتيل، بنتانول، كحول بنتيل |
| إنتشي | إنتشي = 1S/C5H12O/c1-2-3-4-5-6/h6H،2-5H2،1H3 |
خصائص 1-بنتانول
الصيغة 1-بنتانول
صيغة البنتانول هي C₅H₁₁OH. ويتكون من خمس ذرات كربون وإحدى عشرة ذرة هيدروجين ومجموعة هيدروكسيل واحدة (-OH). تمثل الصيغة الترتيب المحدد وأنواع الذرات في جزيء البنتانول.
1-بنتانول الكتلة المولية
يتم حساب الكتلة المولية للبنتانول عن طريق إضافة الكتل الذرية للذرات المكونة له. تبلغ الكتلة المولية للبنتانول حوالي 88.15 جرامًا لكل مول (جم / مول). يوفر معلومات حول كتلة مول واحد من جزيئات البنتانول.
نقطة غليان 1-بنتانول
تبلغ درجة غليان البنتانول حوالي 138 درجة مئوية (280 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول البنتانول السائل إلى الحالة الغازية. تشير نقطة الغليان إلى درجة الحرارة التي تتحول عندها المادة من الطور السائل إلى الطور الغازي.
1- نقطة انصهار البنتانول
تبلغ نقطة انصهار البنتانول حوالي -79 درجة مئوية (-110 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها البنتانول الصلب إلى شكله السائل. تمثل نقطة الانصهار الانتقال من الحالة الصلبة إلى الحالة السائلة.
كثافة 1-بنتانول جم/مل
تبلغ كثافة البنتانول حوالي 0.81 جرام لكل ملليلتر (جم / مل). الكثافة هي مقياس الكتلة لكل وحدة حجم. يشير هذا إلى مدى إحكام تعبئة جزيئات المادة.
1- الوزن الجزيئي للبنتانول
يبلغ الوزن الجزيئي لـ 1-بنتانول حوالي 88.15 جرامًا لكل مول (جم / مول). وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. يُستخدم الوزن الجزيئي في حسابات مختلفة، مثل تحديد عدد الشامات أو كتلة المادة.
هيكل 1-بنتانول
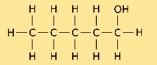
يتكون هيكل البنتانول من سلسلة مستقيمة من خمس ذرات كربون، مع مجموعة الهيدروكسيل (-OH) المرتبطة في نهاية واحدة. لها الصيغة الكيميائية CH₃(CH₂)₃CH₂OH. يلعب هيكل البنتانول دورًا حاسمًا في تحديد خواصه الفيزيائية والكيميائية.
ذوبان 1-بنتانول
البنتانول قابل للذوبان في المذيبات العضوية، مثل الأثير والأسيتون، ولكن ذوبانه محدود في الماء. يشكل روابط هيدروجينية مع جزيئات الماء بسبب وجود مجموعة الهيدروكسيل. تؤثر قابلية ذوبان البنتانول على سلوكه في بيئات مختلفة.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.809-0.814 جم/مل |
| لون | عديم اللون |
| يشم | رائحة مميزة |
| الكتلة المولية | 88.15 جرام/مول |
| كثافة | 0.81 جرام/مل |
| نقطة الانصهار | -79 درجة مئوية (-110 درجة فهرنهايت) |
| نقطة الغليان | 138 درجة مئوية (280 درجة فهرنهايت) |
| نقطة فلاش | 54 درجة مئوية (129 درجة فهرنهايت) |
| الذوبان في الماء | قابل للذوبان قليلا |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل الأثير والأسيتون |
| ضغط البخار | 2.5 ملم زئبق (25 درجة مئوية) |
| كثافة بخار | 3.0 (الهواء = 1) |
| pKa | 16.2 |
| الرقم الهيدروجيني | 6.5-8.5 |
1- البنتانول الأمان والمخاطر
يطرح البنتانول اعتبارات معينة تتعلق بالسلامة والمخاطر. وينبغي التعامل معه بحذر بسبب طبيعته القابلة للاشتعال، حيث تبلغ درجة وميضه 54 درجة مئوية (129 درجة فهرنهايت). تجنب ملامسة اللهب المكشوف أو مصادر الاشتعال. استنشاق أبخرة البنتانول قد يسبب تهيج الجهاز التنفسي. التلامس المباشر مع الجلد قد يسبب تهيجًا أو جفافًا للجلد. إذا تم تناوله عن طريق الخطأ، فإنه قد يسبب اضطرابات في الجهاز الهضمي. يجب الحفاظ على التهوية الكافية عند العمل مع البنتانول لتقليل التعرض للأبخرة. وينبغي استخدام معدات الحماية الشخصية، مثل القفازات ونظارات السلامة، لضمان التعامل الآمن. من المهم مراجعة ورقة بيانات السلامة واتباع بروتوكولات السلامة المناسبة عند العمل مع البنتانول.
| رموز الخطر | قابل للاشتعال (و) |
| وصف الأمان | يُحفظ بعيدًا عن الحرارة/الشرر/اللهب المكشوف/الأسطح الساخنة. استخدم معدات كهربائية/تهوية/إضاءة مقاومة للانفجار. تجنب استنشاق الأبخرة. ارتداء القفازات الواقية / حماية العين / حماية الوجه. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1105 |
| رمز النظام المنسق | 2905.16.00 |
| فئة الخطر | الفئة 3 (السوائل القابلة للاشتعال) |
| مجموعة التعبئة | جنرال الكتريك الثاني |
| تسمم | قد يسبب تهيجا. |
طرق تصنيع 1-بنتانول
طرق مختلفة تسمح بتخليق البنتانول.
الطريقة الشائعة هي الفورميلة الهيدروجينية 1-بوتين ، والتي تتضمن تفاعل 1-بيوتين مع أول أكسيد الكربون والهيدروجين في وجود محفز الروديوم. تؤدي هذه العملية إلى تكوين خليط من وسيطات الألدهيد، تليها الهدرجة لإنتاج البنتانول.
تتضمن الطريقة الأخرى اختزال البنتانال، وهو مركب ألدهيد، باستخدام عامل اختزال مثل بوروهيدريد الصوديوم . رد فعل الاختزال هذا يحول البنتانال إلى البنتانول.
يستطيع الكيميائيون ترطيب 1-بنتين، وهو ألكين، لإنتاج البنتانول. يتضمن هذا التفاعل إضافة الماء عبر الرابطة المزدوجة بين الكربون والكربون المكونة من 1-بنتين، مما يؤدي إلى تكوين البنتانول.
بالإضافة إلى ذلك، يمكن تصنيع البنتانول عن طريق هدرجة حمض البنتانويك، وهو حمض كربوكسيلي. ويحدث التفاعل في وجود محفز مناسب، مثل البلاديوم على الكربون وغاز الهيدروجين، مما يؤدي إلى تحويل حمض البنتانويك إلى البنتانول.
توفر طرق التوليف هذه طرقًا مختلفة للحصول على البنتانول، مما يوفر مرونة الإنتاج اعتمادًا على المواد الخام المتاحة وظروف التفاعل المرغوبة.
استخدامات 1-بنتانول
للبنتانول استخدامات مختلفة في صناعات مختلفة بسبب خصائصه وتعدد استخداماته. فيما يلي بعض تطبيقاته البارزة:
- المذيب: يعمل البنتانول كمذيب في صناعات مثل الأدوية والطلاءات ومستحضرات التجميل، حيث يقوم بإذابة العديد من المركبات العضوية بشكل فعال. إنه يلعب دورًا حاسمًا في تركيب الدهانات والورنيشات ومنتجات العناية الشخصية.
- التخليق الكيميائي: يعمل كوسيط مهم في تركيب المواد الكيميائية المختلفة. يمكن أن يخضع لتفاعلات لإنتاج الإسترات والإيثرات والمشتقات الأخرى، والتي تجد تطبيقات في إنتاج العطور والنكهات والمكونات الصيدلانية.
- الاستخلاص: في عمليات الاستخلاص، يستخدم البنتانول لفصل مركبات معينة عن المنتجات الطبيعية. يساعد على استخلاص مواد قيمة من المواد النباتية، مما يساهم في إنتاج الزيوت العطرية والعطور والروائح.
- عامل التنظيف: تستخدم صناعات مثل الإلكترونيات والبصريات والتصنيع الدقيق البنتانول كعامل تنظيف نظرًا لقدرته على إذابة الزيوت والشحوم والملوثات الأخرى. يضمن التنظيف العميق عن طريق إزالة البقايا من الأسطح.
- مادة مضافة للوقود: في بعض الحالات، يتم استخدام البنتانول كمادة مضافة للوقود لتحسين كفاءة الاحتراق وتقليل الانبعاثات. إنه يحسن الأداء والأثر البيئي للوقود عند مزجه مع البنزين أو أنواع الوقود الأخرى.
- التطبيقات الصناعية: يستخدم البنتانول في العمليات الصناعية المختلفة، بما في ذلك تجريد الطلاء، وإزالة الشحوم المعدنية، والتنظيف الصناعي. خصائصه تجعله فعالاً في إزالة الطلاء والملوثات من الأسطح.
- الأبحاث والمختبرات: يستخدم البنتانول ككاشف أو مذيب في الأبحاث العلمية والمختبرات. يسهل التفاعلات والاستخلاص والتنقية في الإجراءات التجريبية المختلفة.
تسلط تطبيقات البنتانول المتنوعة الضوء على أهميته في العديد من الصناعات، حيث تساهم خصائصه الفريدة في تطوير العديد من المنتجات والعمليات.
أسئلة:
س: أي مما يلي أكثر قابلية للذوبان في الماء: حمض الأسيتيك أم البنتانول أم حمض البيوتانويك أم البنتانال؟
ج: حمض الأسيتيك هو الأكثر قابلية للذوبان في الماء بين المركبات المذكورة.
س: هل البنتانول قابل للذوبان في الماء؟
ج: البنتانول ذو قابلية محدودة للذوبان في الماء.
س: ما هي وظيفة المحفز الحمضي في تعزيز تجفيف 4-ميثيل-2-بنتانول؟
ج: يسهل المحفز الحمضي إزالة جزيء الماء من 4-ميثيل-2-بنتانول، مما يعزز تجفيفه.
س: ما هو الناتج الناتج من تفاعل حامض الكبريتيك وحامض الخليك و1-بنتانول؟
ج: يؤدي التفاعل بين حمض الكبريتيك وحامض الخليك والبنتانول إلى تكوين مركبات الإستر.
س: هل يحتوي البنتانول على رابطة هيدروجينية؟
ج: نعم، يمكن أن يظهر البنتانول رابطة هيدروجينية بسبب وجود مجموعة الهيدروكسيل.
س: كيفية تحضير حمض البنتانويك من 1-بنتانول؟
ج: يمكن الحصول على حمض البنتانويك عن طريق أكسدة 1-بنتانول باستخدام عوامل مؤكسدة مناسبة أو عن طريق التحلل المائي للإستر المقابل له.
س: ما المنتج العضوي الذي يمكن الحصول عليه من تفاعل 1-بنتانول مع CrO3 وH2O وH2SO4؟
ج: تفاعل 1-بنتانول مع CrO3 وH2O وH2SO4 يؤدي إلى تكوين الحمض الكربوكسيلي المقابل.
س: أيهما أقل قابلية للذوبان في الماء 1-بنتانول أم 1-هبتانول؟ يشرح.
ج: البنتانول أقل قابلية للذوبان في الماء من 1-هيبتانول بسبب قصر سلسلته الهيدروكربونية، مما يؤدي إلى تفاعلات أضعف مع جزيئات الماء.
س: ما المنتج العضوي الذي يمكن الحصول عليه من تفاعل 1-بنتانول مع PBr3؟
ج: تفاعل البنتانول مع PBr3 يؤدي إلى استبدال مجموعة الهيدروكسيل، مما يؤدي إلى تكوين 1-بروموبنتان.
