يوديد الكالسيوم (CaI2) هو مركب كيميائي يتكون من الكالسيوم واليود. ويشيع استخدامه كمكمل لليود وفي التصوير الفوتوغرافي كمكثف للتصوير الفوتوغرافي.
| اسم الأيوباك | يوديد الكالسيوم |
| الصيغة الجزيئية | CaI2 |
| CAS رقم | 10102-68-8 |
| المرادفات | ثنائي يوديد الكالسيوم، يوديد الكالسيوم، يوديد الكالسيوم |
| إنتشي | InChI=1S/Ca.2HI/h;2*1H/q+2;;/p-2 |
خصائص يوديد الكالسيوم
صيغة يوديد الكالسيوم
الصيغة الكيميائية ليوديد الكالسيوم هي CaI2. وهذا يدل على وجود ذرتي اليود لكل ذرة كالسيوم في المركب. يوديد الكالسيوم هو مادة صلبة بلورية بيضاء شديدة الذوبان في الماء والمذيبات القطبية الأخرى. ويشيع استخدامه كمصدر لليود في علف الحيوانات وكعنصر من عناصر مكثفات التصوير الفوتوغرافي.
يوديد الكالسيوم الكتلة المولية
يحتوي CaI2 على كتلة مولية تبلغ حوالي 293.89 جم / مول. يتم حساب ذلك عن طريق إضافة الكتل الذرية لـ Ca (40.08 جم/مول) وI (126.9 جم/مول)، في اثنين، نظرًا لوجود ذرتين من ذرات I في CaI2. تعد الكتلة المولية للمركب خاصية مهمة تستخدم في الحسابات المتكافئة، والتي تتضمن تحديد كمية المواد المتفاعلة المطلوبة أو كمية المنتجات المنتجة في التفاعل الكيميائي.
نقطة غليان يوديد الكالسيوم
تبلغ نقطة غليان CaI2 حوالي 1.327 درجة مئوية (2.421 درجة فهرنهايت). ترجع نقطة الغليان العالية هذه إلى الرابطة الأيونية القوية بين ذرات الكالسيوم واليود في المركب. ويشيع استخدام CaI2 في تطبيقات درجات الحرارة المرتفعة، كما هو الحال في إنتاج السبائك والسيراميك.
نقطة انصهار يوديد الكالسيوم
CaI2 لديه نقطة انصهار تبلغ حوالي 779 درجة مئوية (1434 درجة فهرنهايت). ترجع نقطة الانصهار العالية لـ CaI2 إلى الرابطة الأيونية القوية بين ذرات Ca وI في المركب. غالبًا ما يستخدم CaI2 في تطبيقات درجات الحرارة المرتفعة، مثل إنتاج الأملاح المنصهرة وكمائع لنقل الحرارة.
كثافة يوديد الكالسيوم جم/مل
تبلغ كثافة CaI2 حوالي 4.51 جم / مل. ترجع هذه الكثافة العالية إلى وجود ذرتين I لكل ذرة Ca في المركب. يستخدم CaI2 بشكل شائع كمصدر لليود في علف الحيوانات وكعنصر من عناصر مكثفات التصوير الفوتوغرافي.
الوزن الجزيئي يوديد الكالسيوم
يبلغ الوزن الجزيئي لـ CaI2 حوالي 293.89 جم / مول. يتم حساب ذلك عن طريق إضافة الكتل الذرية لـ Ca وI، مضروبة في اثنين نظرًا لوجود ذرتين من ذرات I في المركب. يعد الوزن الجزيئي للمركب خاصية مهمة تستخدم في الحسابات المتكافئة، والتي تتضمن تحديد كمية المواد المتفاعلة المطلوبة أو كمية المنتجات المنتجة في التفاعل الكيميائي.
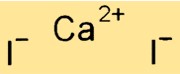
هيكل يوديد الكالسيوم
يحتوي CaI2 على بنية بلورية مشابهة لكلوريد الصوديوم (NaCl). وهو يشكل شبكة مكعبة مركزية الوجه، حيث تشغل أيونات Ca+2 زوايا المكعب وأيونات I- تشغل مراكز الوجوه. الروابط الأيونية القوية بين ذرات Ca وI في المركب تمنحه درجة انصهار وغليان عالية.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 4.51 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 293.89 جرام/مول |
| كثافة | 4.51 جرام/مل |
| نقطة الانصهار | 779 درجة مئوية (1434 درجة فهرنهايت) |
| نقطة الغليان | 1,327 درجة مئوية (2,421 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر يوديد الكالسيوم
يعتبر CaI2 بشكل عام آمنًا وغير سام عند التعامل معه واستخدامه بشكل صحيح. ومع ذلك، قد يكون مهيجًا للجلد والعينين والجهاز التنفسي إذا لامسها. قد يؤدي استنشاق غبار CaI2 إلى تهيج الرئتين والحلق. من المهم ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية وجهاز التنفس الصناعي عند التعامل مع CaI2. لا يعتبر CaI2 قابلاً للاشتعال أو الانفجار، ولا يُعرف أنه مسرطن أو مطفر. من المهم اتباع إجراءات المناولة والتخزين المناسبة لتقليل أي مخاطر محتملة.
| رموز الخطر | اكس ن، ن |
| وصف الأمان | 26-36/37/39-45-61 |
| أرقام تعريف الأمم المتحدة | UN3077 |
| رمز النظام المنسق | 28276000 |
| فئة الخطر | 9 |
| مجموعة التعبئة | ثالثا |
| تسمم | قد يسبب تهيجًا ويكون ضارًا في حالة ابتلاعه أو استنشاقه وقد يتسبب في تلف الأعضاء عند التعرض لفترات طويلة أو متكررة. |
طرق تخليق يوديد الكالسيوم
الطريقة الأكثر شيوعًا لتصنيع CaI2 هي تفاعل حمض الهيدروديك أو اليود مع كربونات الكالسيوم أو هيدروكسيد الكالسيوم.
تفاعل كربونات الكالسيوم أو هيدروكسيد الكالسيوم مع حمض الهيدروديك أو اليود لتصنيع CaI2.
تتضمن الطريقة الثانية تفاعل أكسيد الكالسيوم مع اليود لإنتاج CaI2 وغاز الأكسجين. يمكن لهيدروكسيد الكالسيوم أيضًا إجراء هذا التفاعل بدلاً من أكسيد الكالسيوم .
هناك طريقة أخرى لإنتاج CaI2 تتضمن تفاعل الكالسيوم المعدني مع اليود. يتفاعل الكالسيوم مع اليود لإنتاج CaI2 ويطلق الحرارة. يحل هيدريد الكالسيوم محل الكالسيوم المعدني في التفاعل لإنتاج CaI2.
تفاعل الكالسيوم مع حمض الهيدريوديك في وجود عامل اختزال مثل الحديد أو الزنك ينتج CaI2. تتبخر الحل للحصول على بلورات CaI2.
استخدامات يوديد الكالسيوم
لدى CaI2 العديد من التطبيقات في صناعات مختلفة، بما في ذلك:
- طبياً: يستخدم كمصدر لليود في المكملات الغذائية والمستحضرات الصيدلانية، مثل هرمونات الغدة الدرقية والمستحضرات الصيدلانية الإشعاعية.
- التخليق الكيميائي: يستخدم كمحفز في العديد من التفاعلات الكيميائية، بما في ذلك تحويل الكحولات إلى يوديدات الألكيل وتجفيف الأميدات الأولية إلى النتريل.
- التصوير الفوتوغرافي: يستخدم في إنتاج الأفلام والأوراق الفوتوغرافية كمحسس لبروميد الفضة وكلوريد الفضة.
- الإلكترونيات: تستخدم في صناعة أشباه الموصلات وكاشفات التلألؤ والدروع الإشعاعية.
- صناعة المواد الغذائية: يستخدم كمادة مضافة في صناعة المواد الغذائية لتوفير مصدر لليود لإثراء الغذاء.
- أعلاف الحيوانات: يستخدم كمكمل في أعلاف الحيوانات لمنع نقص اليود وتحسين صحة الحيوان.
- صناعة النفط والغاز: يستخدم أيضًا كمضاف لسوائل الحفر في صناعة النفط والغاز لتثبيت تكوينات الصخر الزيتي ومنع انهيار حفرة البئر.
أسئلة:
س: ما حجم محلول 0.120 M CaI2 الذي يحتوي على 0.078 مول من المذاب؟
ج: لحساب حجم محلول CaI2 الذي يحتوي على 0.078 مول من المذاب، يمكننا استخدام الصيغة: المولات = التركيز × الحجم. وبإعادة ترتيب هذه الصيغة لإيجاد الحجم، نحصل على الحجم = المولات/التركيز. بالتعويض بالقيم المعطاة في السؤال، نحصل على الحجم = 0.078 مول / 0.120 م = 0.65 لتر. وبالتالي، فإن حجم محلول CaI2 الذي يحتوي على 0.078 مول من المذاب هو 0.65 لتر.
س: هل CaI2 قابل للذوبان في الماء؟
ج: نعم، CaI2 قابل للذوبان بدرجة عالية في الماء، مع قابلية ذوبان تبلغ 121 جم / 100 مل عند 20 درجة مئوية.
س: ما اسم المركب الذي صيغته CaI2؟
ج: المركب الذي له الصيغة CaI2 يسمى يوديد الكالسيوم.
س: ما هو CaI2؟
ج: CaI2 هو مركب كيميائي يتكون من الكالسيوم واليود. وهي مادة صلبة بلورية بيضاء أو عديمة اللون، قابلة للذوبان بدرجة عالية في الماء.
س: ما التفاعل الذي يحدث عند الأنود أثناء التحليل الكهربائي لـ CaI2؟
ج: في التحليل الكهربائي لـ CaI2، يتضمن التفاعل الأنودي أكسدة أيونات-I لتكوين غاز اليود والإلكترونات. رد الفعل الإجمالي هو: 2I- -> I2 + 2e-.
س: ما هي صيغة يوديد الكالسيوم؟
ج: صيغة يوديد الكالسيوم هي CaI2.
س: هل CaI2 أيوني أم تساهمي؟
ج: CaI2 مركب أيوني يتكون من كاتيون معدني (Ca2+) وأنيون غير معدني (I-).
