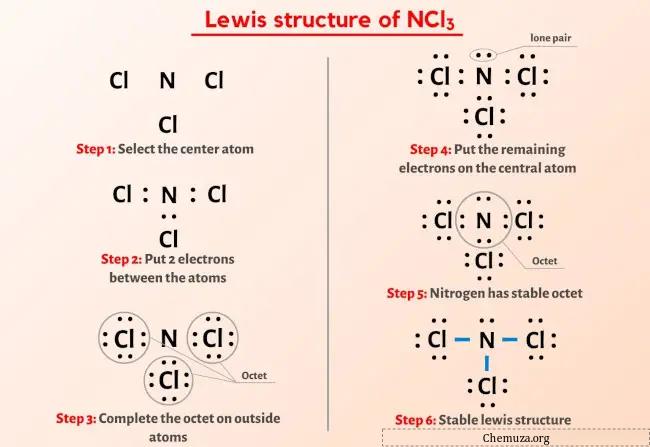
لقد رأيت الصورة أعلاه بالفعل، أليس كذلك؟
اسمحوا لي أن أشرح بإيجاز الصورة أعلاه.
يحتوي هيكل NCl3 Lewis على ذرة نيتروجين (N) في المركز محاطة بثلاث ذرات كلور (Cl). هناك ثلاث روابط فردية بين ذرة النيتروجين (N) وكل ذرة الكلور (Cl). يوجد زوج وحيد في ذرة النيتروجين (N) وثلاثة أزواج وحيدة في ذرات الكلور الثلاثة (Cl).
إذا لم تفهم أي شيء من الصورة أعلاه لبنية لويس لـ NCl3، فابق معي وستحصل على شرح مفصل خطوة بخطوة حول رسم بنية لويس لـ NCl3 .
لذلك دعونا ننتقل إلى خطوات رسم بنية لويس لـ NCl3.
خطوات رسم هيكل NCl3 لويس
الخطوة 1: أوجد إجمالي عدد إلكترونات التكافؤ في جزيء NCl3
من أجل العثور على العدد الإجمالي لإلكترونات التكافؤ في جزيء “NCl” _3 ، تحتاج أولاً إلى معرفة إلكترونات التكافؤ الموجودة في ذرة النيتروجين وكذلك في ذرة الكلور.
(إلكترونات التكافؤ هي الإلكترونات الموجودة في المدار الخارجي لأي ذرة).
سأخبرك هنا بكيفية العثور بسهولة على إلكترونات التكافؤ للنيتروجين وكذلك الكلور باستخدام الجدول الدوري .
إجمالي إلكترونات التكافؤ في جزيء NCl3
→ إلكترونات التكافؤ المعطاة من ذرة النيتروجين:
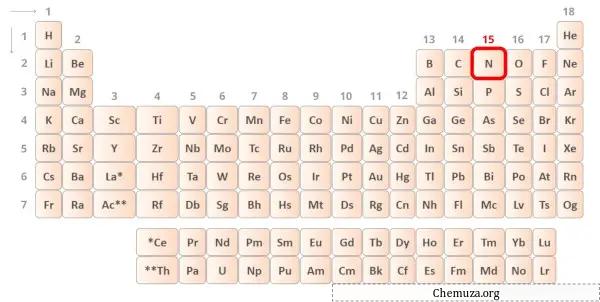
النيتروجين عنصر في المجموعة 15 من الجدول الدوري. [1] ولذلك فإن إلكترونات التكافؤ الموجودة في النيتروجين هي 5 .

يمكنك رؤية إلكترونات التكافؤ الخمسة الموجودة في ذرة النيتروجين كما هو موضح في الصورة أعلاه.
→ إلكترونات التكافؤ المعطاة من ذرة الكلور:

الكلور عنصر في المجموعة 17 من الجدول الدوري. [1] وبالتالي فإن إلكترونات التكافؤ الموجودة في الكلور هي 7 .
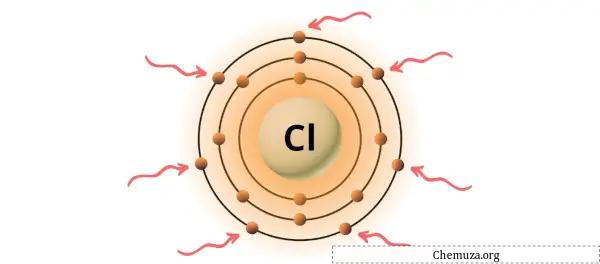
يمكنك رؤية إلكترونات التكافؤ السبعة الموجودة في ذرة الكلور كما هو موضح في الصورة أعلاه.
لذا،
مجموع إلكترونات التكافؤ في جزيء NCl3 = إلكترونات التكافؤ الممنوحة من ذرة نيتروجين واحدة + إلكترونات التكافؤ المتبرع بها من 3 ذرات كلور = 5 + 7(3) = 26 .
الخطوة 2: حدد الذرة المركزية
لاختيار الذرة المركزية، يجب أن نتذكر أن الذرة الأقل سالبية كهربية تبقى في المركز.
الآن هنا الجزيء المعطى هو NCl3 (ثلاثي كلوريد النيتروجين) ويحتوي على ذرات النيتروجين (N) وذرات الكلور (Cl).
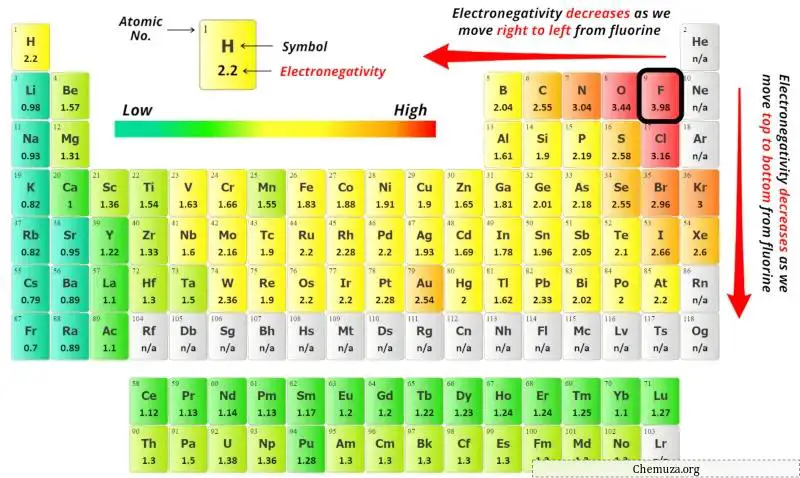
يمكنك رؤية قيم السالبية الكهربية لذرة النيتروجين (N) وذرة الكلور (Cl) في الجدول الدوري أعلاه.
إذا قارنا قيم السالبية الكهربية للنيتروجين (N) والكلور (Cl)، فإن ذرة النيتروجين تكون أقل سالبية كهربية .
هنا، ذرة النيتروجين (N) هي الذرة المركزية وذرات الكلور (Cl) هي الذرات الخارجية.

الخطوة 3: قم بتوصيل كل ذرة عن طريق وضع زوج من الإلكترونات بينهما
الآن في جزيء NCl3، يجب أن نضع أزواج الإلكترونات بين ذرة النيتروجين (N) وذرات الكلور (Cl).
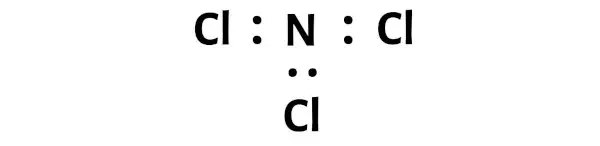
يشير هذا إلى أن النيتروجين (N) والكلور (Cl) مرتبطان كيميائيًا ببعضهما البعض في جزيء NCl3.
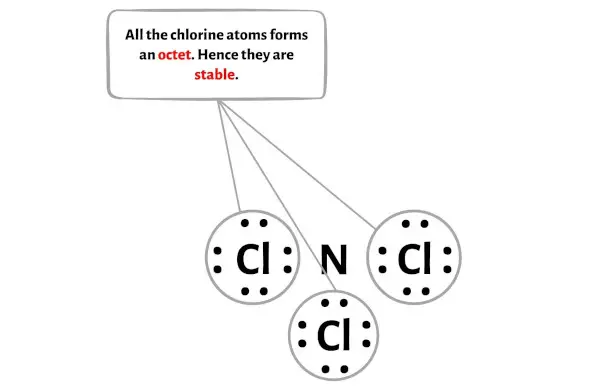
الخطوة 4: جعل الذرات الخارجية مستقرة. ضع زوج إلكترون التكافؤ المتبقي على الذرة المركزية.
في هذه الخطوة تحتاج إلى التحقق من استقرار الذرات الخارجية.
هنا في الرسم التخطيطي لجزيء NCl3 يمكنك أن ترى أن الذرات الخارجية هي ذرات الكلور.
تشكل ذرات الكلور الخارجية هذه ثمانيًا وبالتالي فهي مستقرة.
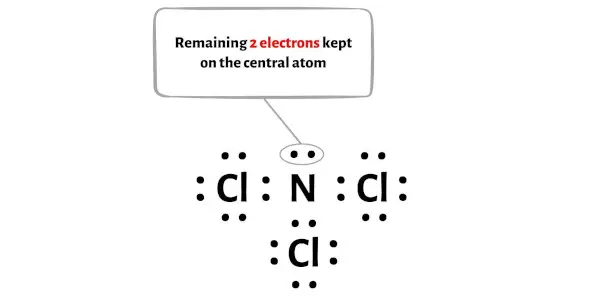
بالإضافة إلى ذلك، في الخطوة 1، قمنا بحساب العدد الإجمالي لإلكترونات التكافؤ الموجودة في جزيء NCl3.
يحتوي جزيء NCl3 على إجمالي 26 إلكترونًا تكافؤًا ، ومن بينها، يُستخدم 24 إلكترونًا تكافؤ فقط في الرسم البياني أعلاه.
إذن عدد الإلكترونات المتبقية = 26 – 24 = 2 .
تحتاج إلى وضع هذين الإلكترونين على ذرة النيتروجين المركزية في الرسم البياني أعلاه لجزيء NCl3.
والآن دعنا ننتقل إلى الخطوة التالية.
الخطوة 5: التحقق من الثماني على الذرة المركزية
في هذه الخطوة، تحتاج إلى التحقق مما إذا كانت ذرة النيتروجين المركزية (N) مستقرة أم لا.
من أجل التحقق من استقرار ذرة النيتروجين المركزية (N)، نحتاج إلى التحقق مما إذا كانت تشكل ثمانيًا أم لا.
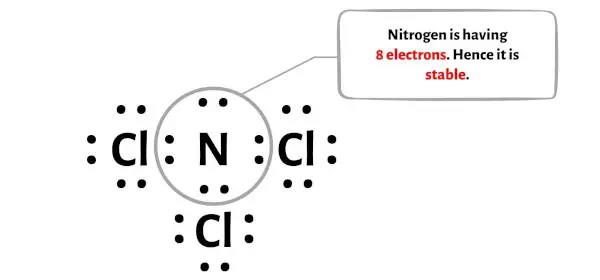
يمكنك أن ترى في الصورة أعلاه أن ذرة النيتروجين تشكل ثمانيًا. وهذا يعني أنه يحتوي على 8 إلكترونات.
وبالتالي فإن ذرة النيتروجين المركزية مستقرة.
لننتقل الآن إلى الخطوة الأخيرة للتحقق مما إذا كانت بنية لويس لـ NCl3 مستقرة أم لا.
الخطوة 6: التحقق من استقرار هيكل لويس
لقد وصلت الآن إلى الخطوة الأخيرة التي تحتاج فيها إلى التحقق من استقرار بنية لويس لـ NCl3.
يمكن التحقق من استقرار بنية لويس باستخدام مفهوم الشحن الرسمي .
باختصار، نحتاج الآن إلى إيجاد الشحنة الرسمية لذرات النيتروجين (N) وكذلك ذرات الكلور (Cl) الموجودة في جزيء NCl3.
لحساب الضريبة الرسمية، يجب عليك استخدام الصيغة التالية:
الشحنة الرسمية = إلكترونات التكافؤ – (الإلكترونات الرابطة)/2 – الإلكترونات غير الرابطة
يمكنك رؤية عدد الإلكترونات الرابطة والإلكترونات غير الرابطة لكل ذرة من جزيء NCl3 في الصورة أدناه.
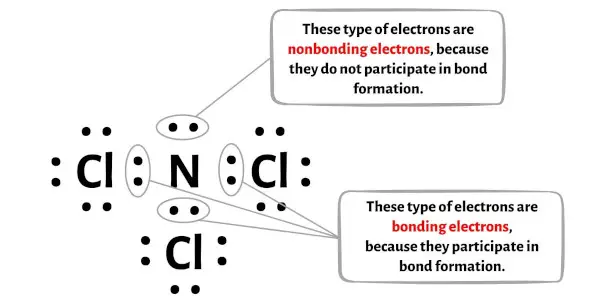
بالنسبة لذرة النيتروجين (N):
إلكترونات التكافؤ = 5 (لأن النيتروجين موجود في المجموعة 15)
إلكترونات الرابطة = 6
الإلكترونات غير الرابطة = 2
بالنسبة لذرة الكلور (Cl):
إلكترونات التكافؤ = 7 (لأن الكلور موجود في المجموعة 17)
إلكترونات الرابطة = 2
الإلكترونات غير الرابطة = 6
| اتهام رسمي | = | إلكترونات التكافؤ | – | (الإلكترونات الملزمة)/2 | – | الإلكترونات غير الرابطة | ||
| لا | = | 5 | – | 6/2 | – | 2 | = | 0 |
| Cl | = | 7 | – | 2/2 | – | 6 | = | 0 |
من حسابات الشحنة الرسمية أعلاه، يمكنك أن ترى أن ذرة النيتروجين (N) وكذلك ذرة الكلور (Cl) لها شحنة رسمية “صفر” .
يشير هذا إلى أن بنية لويس أعلاه لـ NCl3 مستقرة ولا يوجد أي تغيير إضافي في البنية أعلاه لـ NCl3.
في بنية لويس النقطية أعلاه لـ NCl3، يمكنك أيضًا تمثيل كل زوج من إلكترونات الترابط (:) كرابطة واحدة (|). سيؤدي القيام بذلك إلى تكوين بنية لويس التالية لـ NCl3.
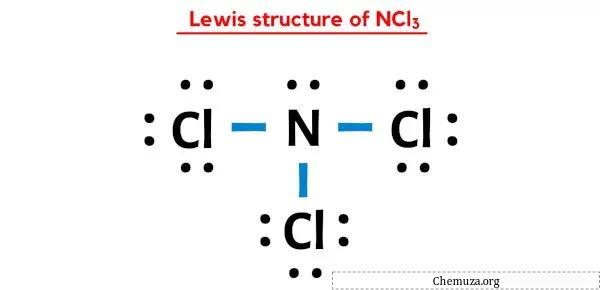
أتمنى أن تكون قد فهمت جميع الخطوات المذكورة أعلاه تمامًا.
لمزيد من التدريب والفهم الأفضل، يمكنك تجربة هياكل لويس الأخرى المدرجة أدناه.
جرب (أو على الأقل شاهد) هياكل لويس هذه لفهم أفضل:
