هيدروكسيد الباريوم مركب كيميائي له الصيغة Ba(OH)2. وهي مادة صلبة بلورية بيضاء شديدة الذوبان في الماء وتستخدم عادة في المختبرات والعمليات الصناعية.
| اسم الأيوباك | ثنائي هيدروكسيد الباريوم |
| الصيغة الجزيئية | با(أوه)2 |
| CAS رقم | 17194-00-2 |
| المرادفات | هيدروكسيد الباريوم (II)، الباريت، هيدرات الباريوم، ثنائي هيدرات الباريوم، مكرر (هيدروكسيد الباريوم)، مكرر (أوكسيدانيل) هيدرات الباريوم |
| إنتشي | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
الكتلة المولية لهيدروكسيد الباريوم
يحتوي هيدروكسيد الباريوم على كتلة مولية قدرها 171.34 جم/مول. ويتكون من أيون باريوم واحد (Ba2+) واثنين من أيونات الهيدروكسيد (OH-)، ولكل منهما كتلة مولية قدرها 137.33 جم/مول و17.01 جم/مول، على التوالي. تعتبر الكتلة المولية لهيدروكسيد الباريوم مهمة لتحديد كمية المركب اللازمة للتفاعلات أو لحساب تركيز المحلول.
صيغة هيدروكسيد الباريوم
الصيغة الكيميائية لهيدروكسيد الباريوم هي Ba(OH)2. ويتكون من أيون باريوم واحد (Ba2+) وأيونات هيدروكسيد (OH-). تعتبر صيغة هيدروكسيد الباريوم مهمة لتحديد كمية المركب المطلوبة في التفاعلات أو لحساب تركيز المحلول. كما أنها تستخدم لتمثيل بنية المركب وسلوكه في المحلول.
نقطة الغليان Ba(OH)2
درجة غليان Ba(OH)2 غير محددة بشكل جيد، لأنها تتحلل قبل غليانها. Ba(OH)2 قاعدة قوية وتتفاعل بسهولة مع ثاني أكسيد الكربون الموجود في الهواء، مكونة كربونات الباريوم والماء. تعتمد درجة حرارة تحلل Ba(OH)2 على تركيز المحلول، ولكنها بشكل عام أعلى من 780 درجة مئوية.
درجة انصهار Ba(OH)2
Ba(OH)2 لديه نقطة انصهار تبلغ 407 درجة مئوية. ويوجد في حالة صلبة على شكل بلورات بيضاء عديمة الرائحة. عند تسخينه، يخضع Ba(OH)2 لتفاعل عكسي لتكوين أكسيد الباريوم والماء. تعتبر نقطة انصهار Ba(OH)2 مهمة في تحديد درجة الحرارة التي يمكن التعامل معها وتخزينها بأمان.
كثافة Ba(OH)2 جم/مل
تبلغ كثافة المادة الصلبة Ba(OH)2 3.22 جم/سم3. في المحلول، تختلف الكثافة حسب التركيز. على سبيل المثال، محلول 10% من Ba(OH)2 له كثافة 1.17 جم/سم3. تعتبر كثافة Ba(OH)2 مهمة في تحديد حجم المحلول اللازم للتفاعلات أو عند التعامل مع المركب.
Ba(OH)2 الوزن الجزيئي
الوزن الجزيئي لـ Ba(OH)2 هو 171.34 جم/مول. وهو مجموع الأوزان الذرية لأيون باريوم واحد وأيوني هيدروكسيد. يعد الوزن الجزيئي لـ Ba(OH)2 مهمًا لتحديد كمية المركب المطلوبة في التفاعلات أو لحساب تركيز المحلول.
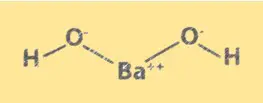
الهيكل Ba(OH)2
يحتوي Ba(OH)2 على بنية بلورية مشابهة لكلوريد الصوديوم. وتتكون من أيونات Ba2+ وأيونات OH-، مرتبة في شبكة مكعبة. تشغل أيونات Ba2+ زوايا المكعب، وتحتل أيونات OH- مركز كل وجه. يعد هيكل Ba(OH)2 مهمًا لفهم خواصه الكيميائية وسلوكه في المحلول.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 3.22 جم/سم3 (صلب) |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 171.34 جرام/مول |
| كثافة | 2.18 جم/سم3 (محلول مائي، 10% وزن/وزن عند 25 درجة مئوية) |
| نقطة الانصهار | 407 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في الكحول والأسيتون |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | القلوية (الرقم الهيدروجيني > 7) |
ملحوظة: القيم الواردة في هذا الجدول هي أوصاف عامة وقد تختلف حسب الظروف وتركيزات المادة المحددة.
سلامة ومخاطر هيدروكسيد الباريوم
Ba(OH)2 هي مادة كاوية وسامة للغاية ويمكن أن تسبب تهيجًا شديدًا للجلد والعينين والجهاز التنفسي. ومن المهم التعامل معه بعناية وارتداء معدات الحماية الشخصية المناسبة، مثل القفازات ونظارات السلامة. إذا تم استنشاقه أو ابتلاعه، فإنه يمكن أن يسبب أضرارا خطيرة للرئتين والجهاز الهضمي والكلى. يجب أن يتم تخزينه في منطقة باردة وجافة وجيدة التهوية بعيدا عن المواد غير المتوافقة مثل الأحماض والمواد المؤكسدة. في حالة حدوث انسكاب أو تعرض، اتبع إجراءات الطوارئ المناسبة، مثل إخلاء المنطقة وطلب الرعاية الطبية على الفور.
| رموز الخطر | تآكل |
| وصف الأمان | تجنب ملامسة الجلد والعينين؛ ارتداء ملابس واقية وقفازات؛ لا تستخدم سوى في مناطق جيدة التهوية |
| معرفات | الأمم المتحدة 1564 |
| رمز النظام المنسق | 2816.40.00 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثانيا |
| تسمم | سامة عن طريق البلع والاستنشاق وامتصاص الجلد. يسبب تهيجًا خطيرًا في الجلد والعين؛ قد يسبب تهيج الجهاز التنفسي وتلف الكلى |
طرق تصنيع هيدروكسيد الباريوم
يمكن تصنيع Ba(OH)2 بعدة طرق، بما في ذلك تفاعل أكسيد الباريوم (BaO) مع الماء (H2O) أو تفاعل كلوريد الباريوم (BaCl2) مع هيدروكسيد الصوديوم (NaOH).
في الطريقة الأولى، يضاف أكسيد الباريوم ببطء إلى الماء المقطر مع التحريك المستمر حتى الوصول إلى التركيز المطلوب. يتم بعد ذلك ترشيح المحلول الناتج وتجفيفه للحصول على الشكل الصلب لـ Ba(OH)2.
وفي الطريقة الثانية، يضاف محلول كلوريد الباريوم ببطء إلى محلول هيدروكسيد الصوديوم مع التحريك المستمر حتى الوصول إلى الرقم الهيدروجيني المطلوب. يتم بعد ذلك ترشيح المحلول الناتج وتجفيفه للحصول على الشكل الصلب لـ Ba(OH)2.
تتضمن الطريقة الأخرى تفاعل كبريتيد الباريوم (BaS) مع الماء لإنتاج Ba(OH)2 وغاز كبريتيد الهيدروجين (H2S).
يمكن أيضًا تحضير Ba(OH)2 عن طريق التحليل الكهربائي لأملاح الباريوم المنصهرة أو عن طريق التحلل الحراري لكربونات الباريوم (BaCO3) عند درجة حرارة عالية.
بشكل عام، يتطلب تركيب Ba(OH)2 معالجة دقيقة واحتياطات السلامة المناسبة بسبب خصائصه الكاوية والسامة للغاية. من المهم اتباع بروتوكولات ولوائح السلامة المناسبة عند العمل مع المواد الخطرة.
استخدامات هيدروكسيد الباريوم
Ba(OH)2 له العديد من الاستخدامات الصناعية والمختبرية بسبب طبيعته شديدة التفاعل وخصائصه القلوية. أحد استخداماته الرئيسية هو استخدامه ككاشف كيميائي في إنتاج المواد الكيميائية المختلفة، بما في ذلك مواد التشحيم والبلاستيك والمبيدات الحشرية.
يستخدم Ba(OH)2 أيضًا كمثبت في PVC والمواد البلاستيكية الأخرى لمنع تغير اللون والتدهور الناتج عن الحرارة والتعرض للأشعة فوق البنفسجية. كما أنه يستخدم في إنتاج أنواع معينة من الزجاج، مثل الزجاج البصري والزجاج ذو معامل الانكسار العالي.
في المختبر، يتم استخدام Ba(OH)2 كمحفز في التفاعلات العضوية المختلفة، مثل تفاعلات الأسترة والأسترة التبادلية. كما يستخدم كمحلول معاير في الكيمياء التحليلية لتحديد الأحماض الضعيفة وفي تحضير المحاليل القياسية.
تطبيق آخر لـ Ba(OH)2 هو إنتاج أكسيد الباريوم، المستخدم في تصنيع أنابيب أشعة الكاثود لأجهزة التلفاز وشاشات الكمبيوتر.
يستخدم Ba(OH)2 أيضًا في معالجة مياه الصرف الصناعي لإزالة الشوائب وتحييد النفايات السائلة الحمضية أو القلوية قبل تصريفها في البيئة.
بشكل عام، يلعب Ba(OH)2 دورًا أساسيًا في العديد من الصناعات والمختبرات، حيث يساهم في إنتاج العديد من المنتجات والعمليات.
أسئلة:
هل هيدروكسيد الباريوم قابل للذوبان؟
نعم، هيدروكسيد الباريوم قابل للذوبان في الماء. عندما يذوب في الماء، فإنه يشكل محلول قلوي مع درجة الحموضة حوالي 12.5. إن قابلية ذوبان Ba(OH)2 في الماء عالية نسبيًا، مع قابلية ذوبان تبلغ حوالي 3.52 جم / 100 مل عند درجة حرارة الغرفة (25 درجة مئوية). يمكن أن تتأثر قابلية ذوبان Ba(OH)2 بعوامل مثل درجة الحرارة والضغط ووجود مواد أخرى في المحلول.
هل هيدروكسيد الباريوم قاعدة قوية؟
نعم، هيدروكسيد الباريوم قاعدة قوية. عند إذابته في الماء، فإنه يتفكك تمامًا ليشكل أيونات الباريوم (Ba2+) وأيونات الهيدروكسيد (OH-) في المحلول. ينتج عن هذا التفكك محلول قلوي للغاية مع درجة حموضة تبلغ حوالي 12.5. الخصائص الأساسية القوية لـ Ba(OH)2 تجعله معادلة فعالة للنفايات السائلة الحمضية ومحفزًا في التفاعلات العضوية المختلفة.
ما هي صيغة هيدروكسيد الباريوم؟
صيغة هيدروكسيد الباريوم هي Ba(OH)2. تشير هذه الصيغة إلى أن كل جزيء من هيدروكسيد الباريوم يحتوي على أيون باريوم واحد (Ba2+) وأيوني هيدروكسيد (OH-). يحمل أيون الباريوم شحنة +2، بينما يحمل أيون الهيدروكسيد شحنة -1. يوازن أيوني الهيدروكسيد في Ba(OH)2 شحنة +2 لأيون الباريوم لتكوين مركب محايد. تعتبر صيغة Ba(OH)2 مهمة لفهم خواصه وتفاعلاته، وكذلك لحساب كتلته المولية وخواصه الفيزيائية والكيميائية الأخرى.
