حمض الفورميك أو HCOOH هو سائل عديم اللون ذو رائحة نفاذة. ويستخدم على نطاق واسع كمادة حافظة ومضاد للبكتيريا وفي صناعة الجلود والمنسوجات والمطاط.
| اسم الأيوباك | حمض الميثانويك |
| الصيغة الجزيئية | HCOH |
| CAS رقم | 64-18-6 |
| المرادفات | حمض الهيدروجين الكربوكسيلي، حمض الفورميل، الأحماض الأمينية، حمض الفورميل، حمض الميتاكربونيك، حمض ثيونيل الفورميك، إلخ. |
| إنتشي | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
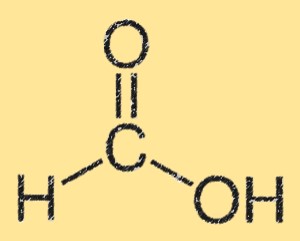
هيكل حمض الفورميك
يتميز هيكل حمض الفورميك بمجموعة حمض الكربوكسيل (-COOH) المرتبطة بذرة كربون واحدة. ترتبط ذرة الكربون أيضًا بذرة هيدروجين وذرة أكسجين. هيكل حمض الفورميك مستو وله روابط هيدروجينية بين مجموعات حمض الكربوكسيل. تؤدي الرابطة الهيدروجينية إلى ذوبانه العالي في الماء.
صيغة حمض الفورميك
الصيغة الكيميائية لحمض الفورميك هي HCOOH. وهو مركب عضوي بسيط يحتوي على ذرة كربون واحدة وذرة أكسجين واحدة وذرتين هيدروجين. إن صيغة حمض الفورميك مهمة في تحديد خواصه الكيميائية والفيزيائية، وكذلك سلوكه تحت الظروف المختلفة. كما أنه يستخدم في الحسابات الكيميائية المختلفة، مثل قياس العناصر الكيميائية والمولارية.
هيكل لويس HCOOH
هيكل لويس لحمض الفورميك (HCOOH) هو كما يلي:
ح
|
ج = س
|
أوه
توجد ذرة الكربون في مركز الهيكل بأربعة إلكترونات تكافؤ. وهو يشكل روابط أحادية مع ذرتي الهيدروجين وذرة الأكسجين التي تحتوي على زوجين من الإلكترونات الحرة. كما تشكل ذرة الأكسجين رابطة مزدوجة مع ذرة الكربون الأخرى التي تحمل زوجًا من الإلكترونات الحرة. يوضح هيكل لويس أن الجزيء له رابطة تساهمية قطبية بسبب الاختلاف في السالبية الكهربية بين ذرات الكربون والأكسجين.
الكتلة المولية لحمض الفورميك
الكتلة المولية لحمض الفورميك، ويسمى أيضًا حمض الميثانويك، هي 46.03 جم/مول. صيغته الكيميائية هي HCOOH مما يدل على أنه يحتوي على ذرة كربون واحدة وذرة أكسجين واحدة وذرتين هيدروجين. تعد الكتلة المولية معلمة مهمة لتحديد كمية المادة اللازمة لتحضير محلول بتركيز معين. على سبيل المثال، لتحضير محلول 1 M من حمض الفورميك، سيكون من الضروري إذابة 46.03 جم من حمض الفورميك في 1 لتر من المذيب.
نقطة غليان حمض الفورميك
نقطة غليان HCOOH هي 100.8 درجة مئوية (213.4 درجة فهرنهايت). وهو سائل عديم اللون وله رائحة نفاذة وقابل للذوبان في الماء بدرجة كبيرة. درجة غليان HCOOH منخفضة نسبيًا، مما يعني أنه يمكن تبخيره وتقطيره بسهولة. هذه الخاصية تجعلها مفيدة في التطبيقات الصناعية المختلفة، مثل إنتاج الأصباغ والبلاستيك والأدوية.
نقطة الانصهار HCOOH
نقطة انصهار HCOOH هي 8.4 درجة مئوية (47.1 درجة فهرنهايت). وهو مادة صلبة في درجة حرارة الغرفة ويمكن الحصول عليه في شكله النقي عن طريق تبريده إلى ما دون نقطة الانصهار. بلورات HCOOH بيضاء اللون وتعطي رائحة نفاذة. نقطة انصهار HCOOH منخفضة نسبيًا مقارنة بالأحماض الكربوكسيلية الأخرى، مما يجعلها مذيبًا مفيدًا لبعض التفاعلات الكيميائية.
كثافة HCOOH جم/مل
تبلغ كثافة HCOOH 1220 جم/مل عند 25 درجة مئوية (77 درجة فهرنهايت). وهو أكثر كثافة من الماء الذي تبلغ كثافته 1000 جم / مل عند نفس درجة الحرارة. تعد كثافة HCOOH خاصية مهمة تحدد قابليته للذوبان في الماء والمذيبات الأخرى. ويؤثر هذا أيضًا على سلوكها في ظل ظروف مختلفة، مثل درجة الحرارة والضغط.
الوزن الجزيئي لحمض الفورميك
الوزن الجزيئي لحمض الفورميك هو 46.03 جم / مول. وهو مركب عضوي بسيط له الصيغة الكيميائية HCOOH. يعد الوزن الجزيئي معلمة مهمة لتحديد الخواص الفيزيائية والكيميائية للمادة. يتم استخدامه لحساب الكميات المختلفة، مثل عدد الشامات والكتلة وحجم المادة.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1.22 |
| لون | عديم اللون |
| يشم | فدان |
| الكتلة المولية | 46.03 جرام/مول |
| كثافة | 1,220 جم/مل |
| نقطة الانصهار | 8.4 درجة مئوية |
| نقطة الغليان | 100.8 درجة مئوية |
| نقطة فلاش | 68 درجة مئوية |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في معظم المذيبات العضوية |
| ضغط البخار | 44.5 ملم زئبق |
| كثافة بخار | 1.5 (الهواء=1) |
| pKa | 3.75 |
| الرقم الهيدروجيني | 2.4 |
سلامة ومخاطر حمض الفورميك
يشكل HCOOH العديد من مخاطر السلامة والمخاطر. وهي مادة شديدة التآكل والسامة يمكن أن تسبب حروقًا شديدة في الجلد وتلفًا في العين عند ملامستها. استنشاق أبخرة HCOOH قد يسبب تهيج الجهاز التنفسي وتلف الرئة. كما أنه قابل للاشتعال ويمكن أن يشتعل عند درجات حرارة عالية، مما يشكل خطر الحريق. ينبغي اتخاذ احتياطات السلامة المناسبة عند التعامل مع HCOOH، بما في ذلك استخدام الملابس الواقية والقفازات وحماية العين. يجب أن يتم تخزينه في منطقة باردة وجافة وجيدة التهوية بعيدا عن المواد غير المتوافقة، مثل العوامل المؤكسدة والقلويات.
| رموز الخطر | تآكل، سامة |
| وصف الأمان | ارتداء القفازات الواقية وحماية العين/الوجه. في حالة ملامسة العينين، اغسلها فورًا بكمية كبيرة من الماء واشطفها بالطبيب. |
| أرقام تعريف الأمم المتحدة | UN1779 |
| رمز النظام المنسق | 2915.11.00 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | الثاني (المتوسط) |
| تسمم | LD50 1.8 جم/كجم (عن طريق الفم، الفئران) |
طرق تصنيع حمض الفورميك
يمكن تصنيع حمض الفورميك بطرق مختلفة.
- تتضمن الطريقة الشائعة تفاعل أول أكسيد الكربون مع الماء في وجود محفز، مثل الروديوم أو الكوبالت. هذه هي عملية فورموكس. تنتج هذه العملية حمض الفورميك وغاز الهيدروجين.
- هناك طريقة أخرى تتضمن أكسدة الفورمالديهايد باستخدام عامل مؤكسد قوي، مثل حمض الكروميك أو برمنجنات البوتاسيوم، في الظروف الحمضية. ينتج عن هذا التفاعل حمض الفورميك والماء.
- إحدى طرق تصنيع حمض الفورميك هي تفاعل فورمات الصوديوم مع حمض الكبريتيك. يؤدي هذا التفاعل إلى تكوين حمض الفورميك وكبريتات الصوديوم كمنتج ثانوي.
- ينتج النمل حمض الفورميك كآلية دفاع طبيعية، ويمكن الحصول عليه من أجسامهم عن طريق التقطير.
- هناك طريقة أخرى لتصنيع HCOOH تتضمن تفاعل ثاني أكسيد الكربون مع الهيدروجين في وجود عامل محفز، مثل كروميت النحاس أو أكسيد الزنك. هذه العملية، المعروفة باسم تفاعل تخليق HCOOH، تنتج HCOOH والماء.
- يمكن أيضًا الحصول على HCOOH من مصادر طبيعية، مثل أوراق نبات القراص، حيث يتواجد بكميات صغيرة.
بشكل عام، هناك عدة طرق متاحة لتخليق HCOOH، ولكل منها مزاياها وعيوبها.
استخدامات حمض الفورميك
يحتوي حمض الفورميك على مجموعة واسعة من التطبيقات في مختلف الصناعات.
- قدرته على منع نمو الكائنات الحية الدقيقة الضارة تجعل حمض الفورميك خيارًا شائعًا كعامل حافظة ومضاد للبكتيريا في علف الحيوانات والسيلاج.
- فهو يساعد على منع نمو الكائنات الحية الدقيقة الضارة في العلف والسيلاج، مما يجعله مادة مضافة مفيدة.
- تستخدم صناعة النسيج حمض الفورميك كعامل صباغة وتشطيب للنسيج لتحسين ثبات اللون وزيادة تقارب الأصباغ مع الألياف.
- يعمل حمض الفورميك كمذيب ووسيط في إنتاج المواد الكيميائية المختلفة مثل حمض الأسيتيك والفورماميد والميثانول.
- حمض الفورميك هو عامل دباغة يستخدم في صناعة الجلود ويساعد على تحسين ملمس المنتجات الجلدية ومتانتها.
- في إنتاج المطاط، يساعد حمض الفورميك في عملية الفلكنة عن طريق العمل كمادة تخثر.
- تستخدم صناعة الأدوية حمض الفورميك كمادة حافظة للقاحات وكمطهر للمعدات الطبية.
- بالإضافة إلى ذلك، يجد حمض الفورميك تطبيقات في إنتاج أدوية مختلفة، بما في ذلك مدرات البول ومضادات الهيستامين.
- حمض الفورميك هو عامل اختزال في تفاعلات التخليق العضوي ومحفز في تفاعلات البلمرة.
- يساعد حمض الفورميك على تعزيز رائحة المنتجات المختلفة، مما يجعله مفيدًا في إنتاج النكهات والعطور.
بشكل عام، يعود تنوع تطبيقات حمض الفورميك في مختلف الصناعات إلى خصائصه الفريدة وطبيعته المتنوعة.
أسئلة:
س: هل حمض الفورميك حمض قوي؟
أ. حمض الفورميك هو حمض ضعيف، مع قيمة pKa تبلغ حوالي 3.75. وهذا يعني أنه لا يتفكك تماما في الماء وهو حمض أضعف من الأحماض القوية مثل حمض الهيدروكلوريك أو حمض الكبريتيك.
س: أيهما أكثر حمضية الفورميك أم حمض الأسيتيك؟
أ. حمض الفورميك أكثر حمضية من حمض الخليك. ويرجع ذلك إلى وجود مجموعة الميثيل في حمض الأسيتيك والتي تعمل على تثبيت الشحنة السالبة على القاعدة المترافقة، مما يجعلها أقل عرضة للانفصال. من ناحية أخرى، حمض الفورميك لديه حجم جزيئي أصغر وذرة كهربية أقوى (الأكسجين)، مما يسهل فصله ويجعله أكثر حمضية.
س: ما هي النملة التي تنتج حمض الفورميك؟
أ. يتم إنتاج حمض الفورميك عن طريق عدة أنواع من النمل، بما في ذلك نمل الخشب، والنمل الناري، وبعض أنواع النحل غير اللاسع. يتم تخزين الحمض في جسم النمل ويستخدم كآلية دفاع ضد الحيوانات المفترسة. عند التهديد، قد تطلق النملة حمض الفورميك من إبرتها أو تطلقه من غدد متخصصة في جسمها.
