نيوبنتان عبارة عن هيدروكربون متفرع للغاية مع أربع مجموعات ميثيل مرتبطة بذرة كربون مركزية. ويشيع استخدامه كمركب مرجعي في التحليل الطيفي بالرنين المغناطيسي النووي وكمادة مضافة للوقود.
| اسم الأيوباك | 2,2-ثنائي ميثيل بروبان |
| الصيغة الجزيئية | C5H12 |
| CAS رقم | 463-82-1 |
| المرادفات | ثنائي ميثيل بروبان، رباعي ميثيل ميثان، 2،2 ثنائي ميثيل بروبان، Neo-C5H12، رقم الأمم المتحدة 2043 |
| إنتشي | إنتشي = 1S/C5H12/c1-5(2,3)4/h1-4H3 |
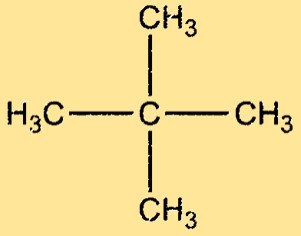
هيكل نيوبنتان
للنيوبنتان بنية متفرعة للغاية، حيث ترتبط أربع مجموعات ميثيل بذرة كربون مركزية. الجزيء متماثل ورباعي السطوح، بزاوية رابطة قدرها 109.5 درجة بين كل زوج من ذرات الكربون المجاورة. جزيء النيوبنتان غير قطبي، مع قوى فان دير فال الضعيفة فقط بين جزيئاته.
نقطة غليان النيوبنتين
نقطة غليان النيوبنتين هي -9.5 درجة مئوية (-15 درجة فهرنهايت) عند الضغط القياسي. ترجع نقطة الغليان المنخفضة هذه إلى ضعف القوى الجزيئية بين جزيئاتها، مما يجعلها سهلة التبخر نسبيًا. نيوبنتان هو غاز عديم اللون في درجة حرارة الغرفة والضغط، ويشيع استخدامه كمركب مرجعي للفصل اللوني للغاز.
الكتلة المولية للنيوبنتان
نيوبنتان، المعروف أيضًا باسم 2،2-ثنائي ميثيل بروبان، له كتلة مولية تبلغ 72.15 جم/مول. وهو عبارة عن هيدروكربون شديد التفرع مع أربع مجموعات ميثيل مرتبطة بذرة كربون مركزية. يمكن حساب الكتلة المولية للنيوبنتان عن طريق إضافة الأوزان الذرية لجميع الذرات في صيغته الجزيئية، وهي C5H12.
نقطة انصهار النيوبنتان
نقطة انصهار النيوبنتين هي -16.6 درجة مئوية (2 درجة فهرنهايت) عند الضغط القياسي. مثل نقطة الغليان، تنتج نقطة الانصهار المنخفضة للنيوبنتان من ضعف قوى الجزيئات بين الجزيئات. نيوبنتان هو جزيء غير قطبي مع قوى فان دير فال ضعيفة بين جزيئاته، لذلك لا يشكل هياكل بلورية قوية.
كثافة النيوبنتان جم/مل
تبلغ كثافة النيوبنتين 0.623 جم / مل عند درجة الحرارة والضغط القياسيين. ترجع هذه الكثافة المنخفضة إلى الوزن الجزيئي المنخفض للنيوبنتان، والذي يبلغ 72.15 جم/مول فقط. النيوبنتان أقل كثافة من الماء، لذلك سوف يطفو على سطح الماء إذا تم خلط الاثنين.
الوزن الجزيئي للنيوبنتان
الوزن الجزيئي لرباعي ميثيل الميثان هو 72.15 جم / مول. وتمثل هذه القيمة مجموع الأوزان الذرية لجميع ذرات الجزيء المكون من خمس ذرات كربون و12 ذرة هيدروجين. الوزن الجزيئي المنخفض لرباعي ميثيل الميثان يجعله مركبًا شديد التقلب وقابل للاشتعال.
صيغة رباعي ميثيل الميثان
الصيغة الجزيئية لرباعي ميثيل الميثان هي C5H12، والتي تمثل عدد وأنواع الذرات الموجودة في الجزيء. تشير الصيغة إلى وجود خمس ذرات كربون و12 ذرة هيدروجين في جزيء رباعي ميثيل الميثان. لا توفر الصيغة الجزيئية معلومات حول ترتيب الذرات داخل الجزيء، والذي يتم تحديده من خلال بنيته.
| مظهر | غاز عديم اللون |
| جاذبية معينة | 0.623 جم/مل عند 20 درجة مئوية |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 72.15 جرام/مول |
| كثافة | 0.623 جم/مل عند 20 درجة مئوية |
| نقطة الانصهار | -16.6 درجة مئوية |
| نقطة الغليان | -9.5 درجة مئوية |
| نقطة فلاش | -49 درجة مئوية |
| الذوبان في الماء | 0.04 جم/لتر عند 20 درجة مئوية |
| الذوبان | غير قابل للذوبان في الماء |
| ضغط البخار | 566 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | 2.5 (الهواء = 1) |
| pKa | ~50 |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر النيوبنتين
رباعي ميثيل الميثان هو غاز شديد الاشتعال ويمكن أن يشكل مخاليط متفجرة مع الهواء. يمكن أن يسبب أيضًا قضمة الصقيع إذا لامس الجلد، لأن درجة غليانه منخفضة جدًا، عند -9.5 درجة مئوية. استنشاق غاز رباعي ميثيل الميثان يمكن أن يسبب الدوخة والغثيان والصداع. من المهم التعامل مع رباعي ميثيل الميثان بعناية وتجنب التعرض للنيران أو الشرر أو مصادر الاشتعال الأخرى. يجب تخزين رباعي ميثيل الميثان في مكان بارد وجاف وجيد التهوية، ومحمي من الحرارة والعوامل المؤكسدة. وينبغي ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع رباعي ميثيل الميثان.
| رموز الخطر | ف+ |
| وصف الأمان | غاز شديد الاشتعال. قد يسبب قضمة الصقيع. استخدم فقط في منطقة جيدة التهوية. يحفظ في اماكن بعيدة عن الحرارة ومصادر الاشتعال. ارتداء القفازات والنظارات الواقية. |
| معرف | UN2451 |
| رمز النظام المنسق | 2901.1 |
| فئة الخطر | 2.1 |
| مجموعة التعبئة | لا أحد |
| تسمم | سمية منخفضة |
طرق تركيب النيوبنتان
هناك عدة طرق مختلفة لتجميع رباعي ميثيل الميثان.
تتضمن الطريقة الشائعة تفاعل الأيزوبيوتين والفورمالدهيد على محفز حمض صلب، مثل الزيوليت. ينتج عن التفاعل كحول نيوبنتيل، والذي يمكن بعد ذلك تجفيفه لإنتاج رباعي ميثيل الميثان.
هناك طريقة أخرى لتصنيع رباعي ميثيل الميثان تتضمن التحلل الحراري لـ 2،2-ثنائي ميثيل بروبان عند درجات حرارة عالية. ينتج عن هذا التفاعل رباعي ميثيل الميثان وهيدروكربونات أخرى.
تتضمن الطريقة الثالثة تفاعل كلوريد الإيثيل والزنك في وجود المغنيسيوم لإنتاج ثنائي إيثيل الزنك، والذي يمكن أن يتفاعل بعد ذلك مع الأيزوبوتيلين لإنتاج رباعي ميثيل الميثان.
يمكن تصنيع رباعي ميثيل الميثان عن طريق هدرجة الأيزوبنتان، والتي تنتج عن نزع الهيدروجين من الأيزوبنتان.
اعتمادا على عوامل مختلفة مثل توافر المواد الخام، والتكلفة، والعائد المطلوب ونقاء المنتج النهائي، يمكن تكييف أساليب مختلفة لتخليق رباعي ميثيل الميثان.
استخدامات نيوبنتان
رباعي ميثيل الميثان له العديد من التطبيقات الصناعية والعلمية الهامة.
- يتم استخدامه كمادة مرجعية لكروماتوغرافيا الغاز، وذلك بفضل نقائه العالي وخصائصه المحددة جيدًا.
- يستخدم رباعي ميثيل الميثان أيضًا كمعيار للقياسات الحرارية والديناميكية الحرارية.
- الاستخدام الرئيسي الآخر لرباعي ميثيل الميثان هو استخدامه كعامل نفخ في إنتاج رغاوي البولي يوريثان، المستخدمة في مجموعة واسعة من التطبيقات، مثل العزل والتوسيد والتعبئة.
- يتم استخدامه كمبرد في أنظمة التبريد، بسبب نقطة غليانه المنخفضة وخصائصه الديناميكية الحرارية الجيدة. ومع ذلك، فقد تم التخلي إلى حد كبير عن استخدامه كمبرد بسبب قابليته العالية للاشتعال وتأثيراته البيئية المحتملة.
- ويستخدم رباعي ميثيل الميثان أيضًا في تصنيع مركبات عضوية أخرى، مثل نيوبنتيل جلايكول، المستخدم في إنتاج الراتنجات والطلاءات والبلاستيك.
خصائصه الفريدة تجعله مركبًا متعدد الاستخدامات وقيمًا لمختلف التطبيقات الصناعية والعلمية. ومع ذلك، يجب دراسة المخاطر المحتملة لرباعي ميثيل الميثان وإدارتها بعناية لضمان الاستخدام الآمن والمسؤول.
أسئلة:
س: ما عدد ذرات الكربون اللولبية التي يحتوي عليها النيوبنتان (2،2-ثنائي ميثيل بروبان)؟
ج: لا يحتوي النيوبنتان على أي ذرات كربون مراوانية. وهو جزيء متماثل ذو هندسة رباعية السطوح حول كل ذرة كربون، لذا فإن جميع ذرات الكربون متكافئة.
س: أيهما أعلى درجة غليان: الهكسان أم البنتان أم النيوبنتان؟
ج: للهكسان أعلى درجة غليان، يليه البنتان ثم النيوبنتان. في الواقع، تزداد نقطة غليان الهيدروكربون مع وزنه الجزيئي ومساحة سطحه النوعية، وكذلك مع قوة القوى بين الجزيئات. يتمتع الهكسان بأعلى وزن جزيئي ومساحة سطح محددة بين المركبات الثلاثة، كما أنه يتمتع بأقوى قوى بين الجزيئات بسبب تركيبه الخطي، مما يؤدي إلى نقطة غليان أعلى. البنتان والنيوبنتان لهما نقاط غليان أقل بسبب حجمهما الجزيئي الأصغر وقوى الجزيئات الأضعف.
