نترات الليثيوم (LiNO₃) هو مركب كيميائي يستخدم في تطبيقات مختلفة. ويتميز بخصائص فريدة، مثل قابليته للذوبان في الماء ودوره في إنتاج السيراميك والزجاج.
| اسم الأيوباك | نترات الليثيوم |
| الصيغة الجزيئية | لينو₃ |
| CAS رقم | 7790-69-4 |
| المرادفات | نترات الليثيوم، ملح الليثيوم لحمض النيتريك، نترات الليثيوم (I). |
| إنشي | إنتشي=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
خصائص نترات الليثيوم
صيغة نترات الليثيوم
صيغة ملح الليثيوم لحمض النيتريك هي LiNO₃. وهو يتألف من ذرة ليثيوم واحدة (Li) وذرة نيتروجين واحدة (N) وثلاث ذرات أكسجين (O). تمثل هذه الصيغة الكيميائية تركيب كل عنصر في المركب.
نترات الليثيوم الكتلة المولية
يحتوي ملح الليثيوم لحمض النيتريك على كتلة مولية تبلغ حوالي 68.95 جم / مول. تشير الكتلة المولية إلى كتلة مول واحد من المادة ويتم حسابها عن طريق إضافة الكتل الذرية لجميع الذرات في الصيغة.
درجة غليان نترات الليثيوم
يحتوي ملح الليثيوم الخاص بحمض النيتريك على نقطة غليان تبلغ حوالي 600 درجة مئوية (1112 درجة فهرنهايت). نقطة الغليان هي درجة الحرارة التي تتحول عندها المادة من سائل إلى غاز تحت الضغط الجوي القياسي.
نقطة انصهار نترات الليثيوم
يحتوي ملح الليثيوم لحمض النيتريك على نقطة انصهار تبلغ حوالي 255 درجة مئوية (491 درجة فهرنهايت). نقطة الانصهار هي درجة الحرارة التي تتحول عندها المادة من الحالة الصلبة إلى الحالة السائلة تحت الضغط الجوي القياسي.
كثافة نترات الليثيوم جم / مل
تبلغ كثافة ملح الليثيوم لحمض النيتريك حوالي 2.38 جم / مل. تمثل الكثافة كتلة المادة لكل وحدة حجم وهي خاصية مهمة لفهم سلوكها الجسدي.
الوزن الجزيئي لنترات الليثيوم
الوزن الجزيئي لملح الليثيوم لحمض النيتريك هو 68.95 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء ويتم التعبير عنه بالجرام لكل مول.
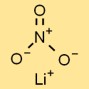
هيكل نترات الليثيوم
يحتوي ملح الليثيوم الخاص بحمض النيتريك على بنية بلورية أيونية، حيث تشكل كاتيونات الليثيوم (Li⁺) وأنيونات النترات (NO₃⁻) نمطًا متكررًا منتظمًا. يساهم هذا الهيكل في استقراره وخصائصه المميزة.
ذوبان نترات الليثيوم
ملح الليثيوم لحمض النيتريك قابل للذوبان بدرجة عالية في الماء. وهذه القابلية العالية للذوبان هي إحدى خصائصه الأساسية وتجعله مفيدًا في تطبيقات مختلفة، مثل إنتاج السيراميك والزجاج.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | لا يوجد |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 68.95 جرام/مول |
| كثافة | 2.38 جرام/مل |
| نقطة الانصهار | 255 درجة مئوية (491 درجة فهرنهايت) |
| نقطة الغليان | 600 درجة مئوية (1112 درجة فهرنهايت) |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والمذيبات العضوية مثل الإيثانول |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | لا يوجد |
يرجى ملاحظة أن بعض الخصائص قد لا تكون قابلة للتطبيق (غير متاح) أو أن لديها بيانات محدودة متاحة لنترات الليثيوم.
السلامة ومخاطر نترات الليثيوم
يطرح ملح الليثيوم الخاص بحمض النيتريك بعض الاعتبارات المتعلقة بالسلامة والمخاطر. قد يكون مهيجًا للجلد والعينين والجهاز التنفسي عند ملامسته أو استنشاقه. عند التعامل معها من الضروري استخدام معدات الحماية المناسبة مثل القفازات ونظارات السلامة. تجنب ابتلاعه، لأن ذلك قد يسبب اضطرابات في الجهاز الهضمي. قم بتخزينه بعيدًا عن المواد غير المتوافقة لتجنب التفاعلات الخطيرة. في حالة حدوث انسكابات أو تسربات، قم باحتوائها وتنظيفها على الفور. بالإضافة إلى ذلك، اتبع دائمًا إرشادات التخزين المناسبة واحتفظ بها في منطقة آمنة وجيدة التهوية. إعطاء الأولوية لممارسات المناولة الآمنة واتباع بروتوكولات السلامة ذات الصلة لتقليل المخاطر المرتبطة بملح الليثيوم وحمض النيتريك.
| رموز الخطر | تحذير |
| وصف الأمان | – مهيجة للجلد والعينين والجهاز التنفسي. – تجنب الابتلاع. – استخدام معدات الحماية. – يحفظ في مكان جيد التهوية. |
| أرقام تعريف الأمم المتحدة | UN1477 |
| رمز النظام المنسق | 28342990 |
| فئة الخطر | 5.1 (عامل مؤكسد) |
| مجموعة التعبئة | ثانيا |
| تسمم | سمية منخفضة، ولكن ينبغي التعامل معها بحذر وتدابير السلامة المناسبة. |
يرجى ملاحظة أن رموز المخاطر المحددة وتوصيات السلامة قد تختلف حسب الولاية القضائية واللوائح. قم دائمًا بالرجوع إلى أوراق بيانات السلامة المناسبة وإرشادات السلامة المحلية عند التعامل مع ملح الليثيوم الخاص بحمض النيتريك.
طرق تصنيع نترات الليثيوم
هناك عدة طرق لتصنيع ملح الليثيوم لحمض النيتريك.
يتضمن النهج الشائع التفاعل بين كربونات الليثيوم (Li₂CO₃) وحمض النيتريك (HNO₃) . خلال هذه العملية، يتفاعل المركبان لإنتاج ملح الليثيوم لحمض النيتريك والماء (H₂O) كمنتجات ثانوية. المعادلة الكيميائية لهذا التفاعل هي:
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
هناك طريقة أخرى وهي تفاعل هيدروكسيد الليثيوم (LiOH) مع حمض النيتريك للحصول على ملح الليثيوم من حمض النيتريك والماء. معادلة التفاعل هي :
LiOH + HNO₃ → LiNO₃ + H₂O
يتم تشكيل ملح الليثيوم لحمض النيتريك عن طريق تحييد حمض النيتريك بأكسيد الليثيوم (Li₂O) أو كربونات الليثيوم. المعادلات هي:
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
في كل هذه الطرق، من المهم التعامل مع الكواشف والمنتجات بحذر بسبب تفاعلها والمخاطر المحتملة. تعتبر تدابير السلامة المناسبة والظروف الخاضعة للرقابة ضرورية أثناء عملية التوليف لضمان نجاح إنتاج ملح الليثيوم لحمض النيتريك.
استخدامات نترات الليثيوم
يجد ملح الليثيوم لحمض النيتريك تطبيقات مختلفة بسبب خصائصه الفريدة. وإليكم استخداماته:
- معالجة الهواء: يعمل ملح الليثيوم من حامض النيتريك كمجفف في تطبيقات معالجة الهواء، حيث يزيل الرطوبة من الهواء لمنع التآكل والحفاظ على الظروف البيئية المثالية.
- الكواشف في التركيب الكيميائي: يعمل كمصدر لأيونات النترات في التفاعلات الكيميائية المختلفة، مما يجعله مفيداً في تركيب مركبات ومواد أخرى.
- المواد الكيميائية المتخصصة: تجد هذه التطبيقات في إنتاج المواد الكيميائية المتخصصة، بما في ذلك المواد الحفازة ومثبطات التآكل.
- الألعاب النارية والألعاب النارية: يلعب ملح الليثيوم الموجود في حامض النيتريك دورًا حاسمًا كعامل مؤكسد في الألعاب النارية، حيث يساهم في اللون الأحمر الساطع الذي يظهر في الألعاب النارية.
- صناعة الأدوية: تستخدم صناعة الأدوية ملح الليثيوم من حمض النيتريك ككاشف في التركيب الكيميائي والأبحاث لبعض التركيبات الصيدلانية.
- بطاريات الليثيوم: على الرغم من عدم استخدامها بشكل مباشر في البطاريات، إلا أن ملح الليثيوم لحمض النيتريك له صلة بصناعة بطاريات أيون الليثيوم. يقوم المصنعون بدمج أملاح الليثيوم المشتقة من ملح الليثيوم لحمض النيتريك في الشوارد المستخدمة في هذه البطاريات.
- المفاعلات النووية: تستخدم بعض أنواع المفاعلات النووية ملح الليثيوم من حامض النيتريك كمبرد لما له من خصائص امتصاص النيوترونات.
- إنتاج السيراميك والزجاج: في عمليات تصنيع السيراميك والزجاج، يعمل ملح الليثيوم لحمض النيتريك كعامل تدفق. إنه يقلل بشكل فعال من درجة انصهار المواد، وبالتالي تحسين قابلية تشغيلها وجودة المنتج.
- سوائل نقل الحرارة: يجد ملح الليثيوم الموجود في حامض النيتريك تطبيقًا في سوائل نقل الحرارة، خاصة في أنظمة الطاقة الشمسية، نظرًا لقابليته العالية للذوبان في الماء. إنه يسهل التبادل الحراري الفعال ويسمح بتخزين الطاقة الحرارية.
أسئلة:
س: ما عدد الذرات الكلية الموجودة في جزيء نترات الليثيوم LiNO₃؟
ج: يوجد 5 ذرات في جزيء ملح الليثيوم من حمض النيتريك: 1 ذرة ليثيوم (Li)، 1 ذرة نيتروجين (N)، و3 ذرات أكسجين (O).
س: ما هي الصيغ الصحيحة لسداسي هيدرات نترات النحاس الثنائي وثنائي هيدرات كرومات الليثيوم؟
ج: الصيغ الصحيحة هي Cu(NO₃)₂·6H₂O لهكساهيدرات نترات النحاس (II) وLi₂CrO₄·2H₂O لثنائي هيدرات كرومات الليثيوم.
س: ما عدد جرامات نترات الليثيوم اللازمة لتحضير 250 مل من محلول تركيزه 0.5 م؟
ج: ستحتاج إلى 17.24 جرامًا من ملح الليثيوم لحمض النيتريك لتحضير 250 مل من محلول 0.5 م.
س: هل نترات الليثيوم أيونية أم تساهمية؟
ج: ملح الليثيوم لحمض النيتريك مركب أيوني.
س: هل LiNO₃ قابل للذوبان في الماء؟
ج: نعم، نترات الليثيوم (LiNO₃) قابلة للذوبان في الماء.
س: ما المعامل الذي يجب أن يظهر قبل LiNO₃ في المعادلة الموزونة؟
ج: يجب أن يظهر المعامل “2” قبل LiNO₃ في المعادلة الموزونة.
س: ما عدد المركبات التالية التي تذوب في الماء؟ الرصاص (OH)₂، LiNO₃، NH₄Br، K₂S
ج: ثلاثة من المركبات قابلة للذوبان في الماء: LiNO₃ وNH₄Br وK₂S.
س: هل LiNO₃ قابل للذوبان؟
ج: نعم، LiNO₃ قابل للذوبان.
س: هل LiNO₃ مائي أم صلب؟
ج: يكون LiNO₃ مائيًا عند إذابته في الماء.
س: هل LiNO₃ حمضي أم قاعدي أم متعادل؟
ج: ملح الليثيوم لحمض النيتريك (LiNO₃) مركب محايد.
س: ما عدد الذرات الكلية الموجودة في جزيء نترات الليثيوم LiNO₃؟
ج: هناك 5 ذرات في جزيء نترات الليثيوم: 1 ذرة ليثيوم (Li)، 1 ذرة نيتروجين (N)، و 3 ذرات أكسجين (O).
س: هل LiNO₃ أيوني أم تساهمي؟
ج: LiNO₃ مركب أيوني.
