نترات الأمونيوم (NH4NO3) مركب كيميائي. يمكن استخدامه كسماد أو كمتفجر. وهو شديد الذوبان في الماء واسترطابي.
| اسم الأيوباك | نترات الأمونيوم |
| الصيغة الجزيئية | NH4NO3 |
| CAS رقم | 6484-52-2 |
| المرادفات | ملح الأمونيوم من حامض النيتريك، نترات الأمونيوم (AN)، نترات الأمونيوم، نيترام، نيترامون |
| إنتشي | إنتشي = 1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
خصائص نترات الأمونيوم
صيغة نترات الأمونيوم
نترات الأمونيوم مركب كيميائي له الصيغة NH4NO3. ويتكون من أيونين: الأمونيوم (NH4+) والنترات (NO3-)، اللذين يرتبطان معًا برابطة أيونية 2 . وهو مسحوق بلوري أبيض قابل للذوبان في الماء بسهولة.
نترات الأمونيوم الكتلة المولية
الكتلة المولية لـ NH4NO3 هي 80.043 جم/مول. ويمكن حسابه عن طريق إضافة الكتل المولية للعناصر المكونة له: النيتروجين والهيدروجين والأكسجين. الكتلة المولية للنيتروجين هي 14.0067 جم / مول، والكتلة المولية للهيدروجين هي 1.00784 جم / مول، والكتلة المولية للأكسجين هي 15.9999 جم / مول.
الكتلة المولية لـ NH4NO3 = 2 × الكتلة المولية للنيتروجين + 4 × الكتلة المولية للهيدروجين + 3 × الكتلة المولية للأكسجين
الكتلة المولية لـ NH4NO3 = 28.0134 جم/مول + 4.03136 جم/مول + 47.9997 جم/مول
الكتلة المولية لـ NH4NO3 = 80.043 جم/مول
درجة غليان نترات الأمونيوم
NH4NO3 ليس له نقطة غليان محددة. ويتحلل عند درجات حرارة عالية، ويطلق غازات مثل النيتروجين والأكسجين وبخار الماء. تختلف درجة حرارة تحلل NH4NO3 حسب النقاء والرطوبة ووجود الشوائب أو المواد المضافة. تبلغ درجة حرارة تحلل NH4NO3 النقي حوالي 210 درجة مئوية أو 483 كلفن.
نقطة انصهار نترات الأمونيوم
تبلغ نقطة انصهار NH4NO3 169.6 درجة مئوية أو 442.8 كلفن. ويخضع لمرحلة انتقالية من البنية البلورية المعينية إلى البنية البلورية المكعبة عند درجة الحرارة هذه. ويمكنه أيضًا تكوين خليط سهل الانصهار مع الماء، والذي لديه نقطة انصهار أقل تبلغ حوالي -16 درجة مئوية أو 257 كلفن.
كثافة نترات الأمونيوم جم/مل
تبلغ كثافة NH4NO3 1.725 جم/مل أو 1725 كجم/م3 عند درجة الحرارة والضغط المحيطين. وهو أكثر كثافة من الماء الذي تبلغ كثافته حوالي 1 جم / مل أو 1000 كجم / م 3 تحت نفس الظروف. تتناقص كثافة NH4NO3 مع زيادة درجة الحرارة بسبب التمدد الحراري.
الوزن الجزيئي لنترات الأمونيوم
الوزن الجزيئي لـ NH4NO3 هو نفس الكتلة المولية، وهي 80.043 جم/مول. الوزن الجزيئي هو كتلة مول واحد أو 6.022 × 10^(23) جزيء من NH4NO3. يمكن أيضًا التعبير عن الوزن الجزيئي بوحدات الكتلة الذرية (amu)، والتي تُعرف بأنها تساوي واحدًا على اثني عشر من كتلة ذرة الكربون-12.
الوزن الجزيئي لـ NH4NO3 في amu هو 80.043 x (1/12) x (10^(23)) amu
يبلغ الوزن الجزيئي لـ NH4NO3 في amu حوالي 6.669 × 10^(23) amu
هيكل نترات الأمونيوم
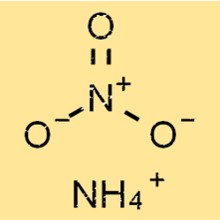
يحتوي NH4NO3 على بنية أيونية بسيطة، تتكون من أيونات الأمونيوم موجبة الشحنة وأيونات النترات سالبة الشحنة. أيون الأمونيوم له شكل رباعي السطوح، مع أربع ذرات هيدروجين مرتبطة بذرة نيتروجين مركزية بواسطة روابط تساهمية.
NH4+
ح
|
HNH
|
ح
أيون النترات له شكل مستو مثلثي، حيث ترتبط ثلاث ذرات أكسجين بذرة نيتروجين مركزية بروابط تساهمية، إحداها رابطة مزدوجة.
رقم 3-
أوه
||
أوه
ذوبان نترات الأمونيوم
تشير قابلية ذوبان NH4NO3 إلى كمية هذا المركب التي تذوب في الماء أو المذيبات الأخرى. NH4NO3 شديد الذوبان في الماء وتزداد ذوبانه مع درجة الحرارة. على سبيل المثال، عند 20 درجة مئوية، يمكن أن يذوب 150 جم من NH4NO3 في 100 مل من الماء، ولكن عند 100 درجة مئوية، يمكن أن يذوب 1024 جم في نفس الكمية من الماء. يذوب NH4NO3 أيضًا في الميثانول والإيثانول والأسيتون، ولكن ليس في ثنائي إيثيل إيثر أو الكلوروفورم. تعتمد ذوبان NH4NO3 على وجود مواد أخرى، مثل الأحماض أو القواعد أو الأملاح أو المركبات العضوية. يمكن لبعض هذه المواد أن تؤثر على ثبات NH4NO3 وتتسبب في تحلله أو انفجاره.
| مظهر | مادة صلبة بلورية بيضاء |
| كثافة محددة | 1,725 |
| لون | أبيض أو رمادي |
| يشم | عديم الرائحة |
| الكتلة المولية | 80.043 جم/مول |
| كثافة | 1.725 جم/مل أو 1725 كجم/م3 |
| نقطة الانصهار | 169.6 درجة مئوية أو 442.8 كلفن |
| نقطة الغليان | تقريبًا. 210 درجة مئوية أو 483 كلفن (تتحلل) |
| نقطة فلاش | غير قابل للاشتعال |
| الذوبان في الماء | ماص للحرارة، 118 جم/100 مل (0 درجة مئوية)، 150 جم/100 مل (20 درجة مئوية)، 297 جم/100 مل (40 درجة مئوية)، 410 جم/100 مل (60 درجة مئوية)، 576 جم/100 مل (80 درجة مئوية)، 1024 جم/100 مل (100 درجة مئوية) |
| الذوبان | قابل للذوبان في الماء، الميثانول، الإيثانول، الأسيتون. غير قابل للذوبان في ثنائي إيثيل الأثير والكلوروفورم |
| ضغط البخار | لا يكاد يذكر في درجة حرارة الغرفة |
| كثافة بخار | غير قابل للتطبيق (صلب) |
| pKa | 9.25 (لـ NH4+) |
| الرقم الهيدروجيني | 5.0-6.0 (محلول مائي 10%) |
السلامة ومخاطر نترات الأمونيوم
من المهم معرفة سلامة ومخاطر NH4NO3 لأي شخص يتعامل مع هذا المركب الكيميائي أو يخزنه. NH4NO3 هو عامل مؤكسد يمكن أن يزيد من حدة الحريق ويسبب انفجارات إذا تم خلطه بمواد قابلة للاحتراق أو تعرضه للحرارة أو الصدمة أو التلوث. يمكن أن يطلق NH4NO3 أيضًا غازات سامة مثل أكاسيد النيتروجين والأمونيا عند تحللها. ولذلك، يجب على الناس اتباع احتياطات السلامة هذه عند التعامل مع NH4NO3:
- قم بتخزينه في مكان بارد وجاف وجيد التهوية بعيدًا عن مصادر النار والمواد العضوية والأحماض والمعادن وغيرها من المواد غير المتوافقة.
- ارتداء الملابس الواقية والقفازات وحماية العين والوجه عند التعامل.
- تجنب خلق الغبار واستخدم التهوية الكافية عند النقل.
- اغسل اليدين والوجه جيداً بعد التعامل معه.
- لا يجوز تناوله أو استنشاقه، ويجب استشارة الطبيب في حالة التعرض له.
- أبلغ مستجيبي الطوارئ المحليين بوجود NH4NO3 في المنشأة وقم بإعداد خطة الاستجابة للطوارئ.
| رموز الخطر | O (عامل مؤكسد)، Xi (مهيج) |
| وصف الأمان | S17 (الابتعاد عن المواد القابلة للاحتراق)، S26 (في حالة ملامسة العينين، اشطفهما فورًا بكمية كبيرة من الماء واطلب المشورة الطبية)، S36/37/39 (ارتداء ملابس واقية مناسبة وقفازات وحماية العين/الوجه)، S42 (أثناء التبخير/الرش، يجب ارتداء معدات التنفس المناسبة) |
| أرقام تعريف الأمم المتحدة | S17 (الابتعاد عن المواد القابلة للاحتراق)، S26 (في حالة ملامسة العينين، اشطفهما فورًا بكمية كبيرة من الماء واطلب المشورة الطبية)، S36/37/39 (ارتداء ملابس واقية مناسبة وقفازات وحماية العين/الوجه)، S42 (أثناء التبخير/الرش، يجب ارتداء معدات التنفس المناسبة) |
| رمز النظام المنسق | 3102.30 ( نترات الأمونيوم، وإن كانت في محلول مائي) |
| فئة الخطر | 5.1 (عامل مؤكسد) |
| مجموعة التعبئة | III (خطر منخفض) |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران) = 2085-5300 ملغم/كغم |
طرق تصنيع نترات الأمونيوم
لإنتاج هذا المركب الكيميائي، الذي يستخدم على نطاق واسع كسماد ومتفجرات، يستخدم الكيميائيون طرقًا مختلفة لتصنيع NH4NO3. هناك طرق مختلفة لتصنيع NH4NO3، ولكن الأكثر شيوعا هي:
- عملية هابر بوش وأوستوالد: تتضمن هذه الطريقة تفاعل غازي النيتروجين والهيدروجين لتكوين الأمونيا، ثم أكسدة الأمونيا مع الهواء لتكوين حمض النيتريك . لتكوين NH4NO3، يقومون بتحييد الأمونيا وحمض النيتريك. تتطلب هذه الطريقة درجة حرارة وضغطًا وطاقة عالية، وتنبعث منها الكثير من ثاني أكسيد الكربون.
- تفاعل الاستبدال: تتضمن هذه الطريقة تفاعل ملح الأمونيوم الذائب مع ملح النترات الذائب لتكوين NH4NO3 وملح آخر. على سبيل المثال، يمكن أن تتفاعل كبريتات الأمونيوم ونترات الباريوم لتكوين NH4NO3 وكبريتات الباريوم. هذه الطريقة بسيطة ولا تتطلب درجة حرارة أو ضغط عاليين، ولكنها تنتج منتجًا ثانويًا قد يحتاج إلى فصله أو التخلص منه.
- عملية البلازما: تتمثل هذه الطريقة في استخدام البلازما عند درجة حرارة منخفضة وضغط منخفض لتثبيت النيتروجين من الهواء في التربة، وبالتالي تكوين NH4NO3 مباشرة في التربة. ولا تتطلب هذه الطريقة غاز الهيدروجين أو المواد الحفازة ولا ينبعث منها ثاني أكسيد الكربون. ويمكنه أيضًا إثراء التربة بالنيتروجين وتحسين نمو النبات.
استخدامات نترات الأمونيوم
فيما يلي بعض استخدامات NH4NO3:
- الأسمدة: NH4NO3 هو مصدر شائع للنيتروجين للنباتات، حيث يحتوي على ما يقرب من 33.5٪ نيتروجين، وكلها متاحة لامتصاصها من قبل النباتات. يقوم المصنعون بتغطية كريات كربونات الأمونيوم البيضاء أو الرمادية بالطين لمنعها من التكتل وامتصاص الرطوبة. ويمكنهم تطبيقه في شكل صلب أو في محلول لأن الماء يذوبه بسهولة.
- المادة المتفجرة: NH4NO3 هو عامل مؤكسد يمكنه تعزيز تفجير المتفجرات الأخرى، مثل النتروجليسرين أو TNT أو RDX أو مسحوق الألومنيوم. متفجرات صناعية مستخدمة على نطاق واسع، والتي تمثل 80٪ من المتفجرات المستخدمة في أمريكا الشمالية، تحتوي على ANFO (NH4NO3 وزيت الوقود) كمكون رئيسي لها. وهو يتطلب بادئًا قويًا لتفجيره عند استخدامه في الأجهزة المتفجرة المرتجلة، ولكن يمكن للتطبيقات الصناعية استخدامه أيضًا.
- الألعاب النارية: يمكن للألعاب النارية استخدام NH4NO3 لإنشاء تأثيرات مختلفة، مثل الدخان والشرر والنجوم والبرق. ويمكن أيضًا استخدام الكمادات الباردة، مما ينتج عنه تفاعل ماص للحرارة عند مزجه بالماء.
- الاستخدامات الأخرى: يستخدم كمقدمة لأكسيد النيتروز (غاز الضحك)، ومخدر ووقود. يمكن استخدام أكاسيد النيتروجين كمواد ماصة، ويمكن استخدام الخميرة والمضادات الحيوية كمواد مغذية، ويمكن استخدام خلطات التجميد كمكونات.
أسئلة:
س: من أين يأتي سماد نترات الأمونيوم؟
ج: سماد NH4NO3 هو منتج صناعي ناتج عن تفاعل الأمونيا مع حمض النيتريك. ويتم الحصول على الأمونيا من الغاز الطبيعي أو من مصادر أخرى، ويتم إنتاج حمض النيتريك عن طريق أكسدة الأمونيا مع الهواء. يمكن أيضًا إنتاج سماد NH4NO3 باستخدام عملية البلازما التي تعمل على تثبيت النيتروجين من الهواء في التربة.
س: ما هي نترات الأمونيوم؟
ج: NH4NO3 مركب كيميائي له الصيغة NH4NO3. وهو ملح بلوري أبيض يتكون من أيونات الأمونيوم والنترات. وهو قابل للذوبان بدرجة عالية في الماء واسترطابي في الحالة الصلبة، على الرغم من أنه لا يشكل الهيدرات.
س: ما هو استخدام نترات الأمونيوم؟
ج: يستخدم NH4NO3 أساسًا لغرضين: كسماد وكمتفجر. كسماد، فإنه يزود النباتات بالنيتروجين الضروري لنموها والتمثيل الغذائي. وباعتباره مادة متفجرة، فإنه يعمل بمثابة مادة مؤكسدة تشجع على تفجير المتفجرات الأخرى، مثل ANFO (NH4NO3 وزيت الوقود) 1 . ويمكن استخدامه أيضًا لأغراض أخرى، مثل صنع أكسيد النيتروز (غاز الضحك)، والكمادات الباردة، والألعاب النارية، ومغذيات الخميرة.
س: ما هي الصيغة الجزيئية لنترات الأمونيوم؟
ج: الصيغة الجزيئية لنترات الأمونيوم هي NH4NO3. تبلغ كتلته المولية 80.043 جم/مول ويحتوي على 35% نيتروجين بالكتلة.
س: مما يتكون سماد نترات الأمونيوم؟
ج: يتكون سماد NH4NO3 من NH4NO3 وفي بعض الأحيان إضافات أخرى، مثل الطين أو عوامل مقاومة التكتل أو المثبتات. يحتوي الصف التجاري على ما يقرب من 33.5% من النيتروجين، وكلها في أشكال متاحة لامتصاص النبات.
س: هل نترات الأمونيوم حمض أم قاعدة؟
ج: NH4NO3 ليس حمضاً ولا قاعدة، بل هو ملح. يمكن أن ينفصل في الماء إلى أيونات الأمونيوم والنترات، والتي يمكن أن تكون بمثابة أحماض أو قواعد ضعيفة اعتمادًا على الرقم الهيدروجيني للمحلول. يحتوي أيون الأمونيوم على pKa يبلغ 9.25، مما يعني أنه يمكنه التبرع ببروتون والعمل كحمض في المحاليل الأساسية. لا يحتوي أيون النترات على pKa، مما يعني أنه لا يمكنه التبرع أو قبول البروتونات، لكنه يمكن أن يعمل كقاعدة، مكونًا حمض النيتريك مع أيونات الهيدرونيوم في المحاليل الحمضية.
س: انفجار نترات الأمونيوم؟
ج: انفجار NH4NO3 هو تفاعل كيميائي عنيف يحدث عندما يتحلل NH4NO3 بسرعة ويطلق كميات كبيرة من الغازات، مثل النيتروجين والأكسجين وبخار الماء. يمكن أن يحدث التحلل عن طريق الحرارة أو الصدمة أو الاحتكاك أو التلوث أو الحبس. يمكن أن يسبب انفجار NH4NO3 أضرارًا جسيمة للمباني والأشخاص والبيئة. بعض الأمثلة على انفجارات NH4NO3 هي كارثة مدينة تكساس عام 1947، وانفجار أوباو عام 1921، وانفجار تيانجين عام 2015، وانفجار بيروت عام 2020.
س: كيف يمكن شراء نترات الأمونيوم؟
ج: قد يتطلب شراء NH4NO3 ترخيصًا أو تصريحًا حسب البلد أو المنطقة التي تعيش فيها. وفي الواقع، يمكن استخدام NH4NO3 في صنع المتفجرات أو الأجهزة المتفجرة المرتجلة التي يمكن أن تشكل تهديدًا للسلامة العامة. قد يُطلب منك أيضًا تقديم هويتك وعنوانك وتفاصيل الاتصال والاستخدام المقصود للمنتج عند شراء NH4NO3. يمكن شراء NH4NO3 من الموردين أو الموزعين المعتمدين الذين يلتزمون باللوائح والمعايير المحلية. يجب عليك أيضًا اتباع إرشادات التخزين والتعامل المناسبة لتجنب الحوادث أو سوء استخدام NH4NO3.
