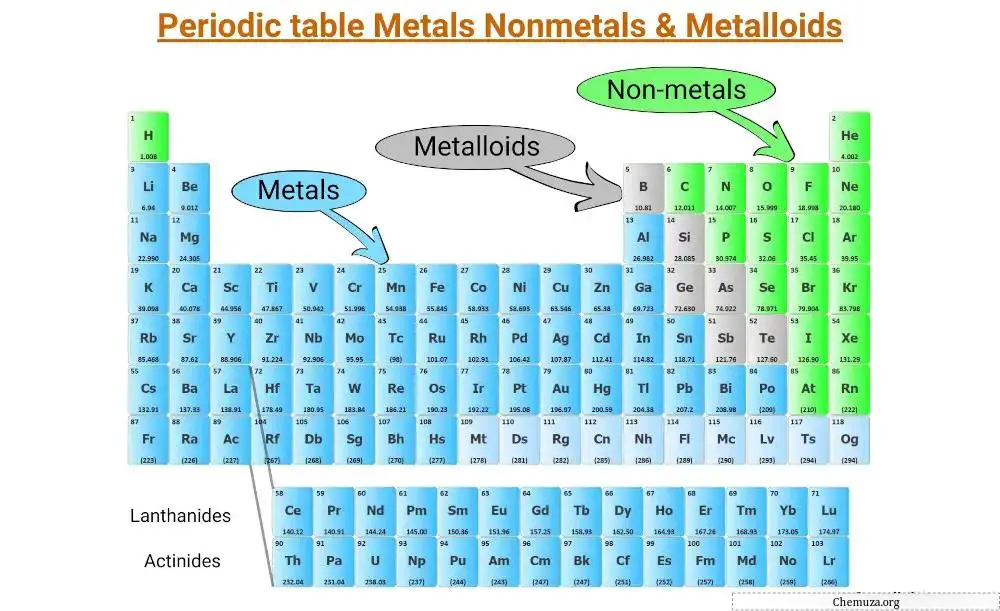
يمكن تصنيف جميع عناصر الجدول الدوري إلى 3 فئات رئيسية؛
- المعادن
- غير المعادن و
- الفلزات
المعادن بشكل عام لامعة، وموصلة، ومطاطة، وتشكل غالبية العناصر الموجودة على الجانب الأيسر من الجدول الدوري.
من ناحية أخرى، تميل المواد غير المعدنية إلى أن تكون هشة (بعضها غازات) وضعيفة التوصيل، وتقع في المقام الأول على الجانب الأيمن من الطاولة.
تشترك أشباه الفلزات في خصائصها مع المعادن واللافلزات وتقع على طول “الدرج” الذي يفصل بين المعادن واللافلزات.
دعونا نستكشف المزيد عن المعادن واللافلزات وأشباه الفلزات في الجدول الدوري.
المعادن
تشكل المعادن غالبية العناصر في الجدول الدوري وتقع على الجانب الأيسر من خط “الدرج” الذي يفصل المعادن عن غير المعادن.
تشترك المعادن في خصائص معينة مثل الموصلية الكهربائية العالية واللمعان والليونة والقدرة على التحمل .
هناك خمسة أنواع رئيسية من المعادن:
- الفلزات القلوية ، الموجودة في المجموعة 1 من الجدول الدوري، هي معادن ناعمة شديدة التفاعل تتفاعل بعنف مع الماء .
- المعادن الأرضية القلوية ، الموجودة في المجموعة 2، هي أيضًا شديدة التفاعل، ولكنها أقل تفاعلاً من الفلزات القلوية . وهي مكونات مهمة للمعادن في القشرة الأرضية.
- تعد المعادن الانتقالية ، الموجودة في المجموعات من 3 إلى 11، من أكثر المعادن شهرة، بما في ذلك الحديد والذهب والفضة. لديهم نقاط انصهار عالية وغالبًا ما تحتوي على مركبات ملونة. [1]
- تُعرف اللانثانيدات والأكتينيدات ، الموجودة في الكتلة f، باسم “المعادن الأرضية النادرة”. لديهم خصائص فريدة مثل الخصائص المغناطيسية والإنارة. [2]
- تشمل المعادن ما بعد الانتقالية ، الموجودة خارج الكتلتين d وf، معادن مثل الألومنيوم والقصدير والرصاص وما إلى ذلك. يتم استخدامها لمجموعة واسعة من التطبيقات مثل البناء والنقل والإلكترونيات.
بشكل عام، للمعادن العديد من الاستخدامات المهمة في حياتنا اليومية، بدءًا من بناء الهياكل والآلات وحتى أن تصبح مكونات أساسية للتكنولوجيا الحديثة.
غير المعادن
اللافلزات هي مجموعة من العناصر الكيميائية التي ليس لها خصائص معدنية. وهي تقع على الجانب الأيمن من الجدول الدوري، باستثناء الهيدروجين الذي يقع في الزاوية اليسرى العليا.
يمكن تقسيم اللافلزات إلى عدة فئات، بما في ذلك:
- الغازات النبيلة: وهي عناصر مستقرة وخاملة، أي أنها لا تتفاعل بسهولة مع العناصر الأخرى. وتشمل الغازات النبيلة الهيليوم والنيون والأرجون والكريبتون والزينون والرادون.
- الهالوجينات: وهي مواد لافلزية شديدة التفاعل وتشكل بسهولة مركبات مع عناصر أخرى. تشمل الهالوجينات الفلور والكلور والبروم واليود والأستاتين.
- اللافلزات الأخرى: وتشمل عناصر مثل الهيدروجين والكربون والنيتروجين والأكسجين والفوسفور والكبريت والسيلينيوم.
تمتلك اللافلزات العديد من الخصائص الفيزيائية والكيميائية التي تميزها عن المعادن.
على سبيل المثال، تميل اللافلزات إلى أن تكون موصلة رديئة للحرارة والكهرباء، ولها درجات انصهار وغليان أقل من المعادن.
تميل اللافلزات أيضًا إلى تكوين أيونات سالبة عند التفاعل مع المعادن، بينما تميل المعادن إلى تكوين أيونات موجبة. [3]
الفلزات
أشباه الفلزات هي عناصر تشترك في خصائصها مع المعادن وغير المعادن.
وهي تقع على طول “الدرج” الذي يفصل بين فئتي الجدول الدوري.
تشتمل أشباه الفلزات على عناصر مثل:
- البورون ،
- السيليكون ,
- الجرمانيوم ،
- الزرنيخ ،
- الأنتيمون ، و
- التيلوريوم .
تميل أشباه الفلزات إلى امتلاك خصائص تجعلها مفيدة في التطبيقات التكنولوجية والصناعية.
على سبيل المثال، يعتبر السيليكون عنصرا هاما في أشباه الموصلات، في حين يستخدم البورون في إنتاج سبائك قوية وخفيفة الوزن. [4]
تم استخدام الزرنيخ في مجموعة متنوعة من التطبيقات، بما في ذلك المواد الحافظة للأخشاب والمبيدات الحشرية، على الرغم من أنه يُعرف الآن بأنه مادة سامة. [5]
إحدى الخصائص الرئيسية للفلزات هي قدرتها على توصيل الكهرباء في ظل ظروف معينة.
على سبيل المثال، يعتبر السيليكون من أشباه الموصلات، مما يعني أنه يمكن استخدامه للتحكم في تدفق الكهرباء في الأجهزة الإلكترونية.
كما أن أشباه الفلزات هشة بشكل عام ويمكن أن تنكسر تحت الضغط، مثل المعادن اللافلزية الصلبة.
وبشكل عام، فإن الخصائص الفريدة للفلزات تجعلها عناصر مهمة في مختلف التطبيقات، بما في ذلك التكنولوجيا والإلكترونيات.
ملخص
يتضمن الجدول الدوري ثلاث فئات رئيسية من العناصر: المعادن، واللافلزات، وأشباه الفلزات.
توجد المعادن على الجانب الأيسر من الجدول الدوري ولها خصائص مثل الموصلية الكهربائية العالية، واللمعان، والليونة، والمرونة.
من ناحية أخرى، تقع اللافلزات على الجانب الأيمن من الجدول الدوري وهي بشكل عام هشة وضعيفة التوصيل.
تشترك أشباه الفلزات في خصائصها مع المعادن واللافلزات وتقع على طول “الدرج” الذي يفصل بين الفئتين.
