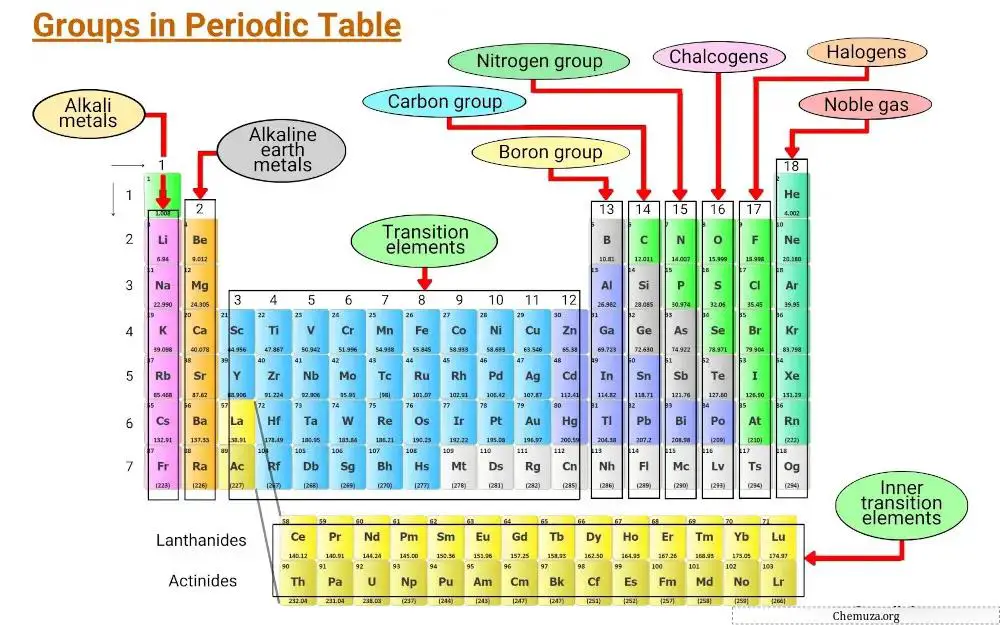
يتم تجميع العناصر على أساس الخصائص المشتركة، بما في ذلك التكوينات الإلكترونية وسلوك إلكترونات التكافؤ.
تسمى الأعمدة الرأسية في الجدول الدوري بالمجموعات، وهناك 18 مجموعة في الجدول الدوري، لكل منها مجموعة من الخصائص الخاصة بها والتي تحدد كيفية تفاعل العنصر مع العناصر الأخرى وتكوين المركبات.
في هذه المقالة، سوف نستكشف المجموعات المختلفة في الجدول الدوري.
دعونا نصل إلى ذلك مباشرة!.
المجموعة 1: المعادن القلوية
تُعرف المجموعة الأولى من الجدول الدوري بالفلزات القلوية .
تشمل هذه المجموعة الليثيوم والصوديوم والبوتاسيوم والروبيديوم والسيزيوم والفرانسيوم.
تُعرف الفلزات القلوية بنعومتها، ونقطة انصهارها المنخفضة، وتفاعلها العالي مع الماء والهواء.
الفلزات القلوية شديدة التفاعل لأنها تحتوي على إلكترون واحد فقط في غلافها الخارجي، والذي تتخلى عنه بسهولة لتكوين أيونات موجبة. [1]
وهذا يجعلها موصلة ممتازة للكهرباء ومفيدة في العديد من التطبيقات، بما في ذلك البطاريات والعمليات الصناعية.
ومع ذلك، بسبب تفاعلها العالي، يجب التعامل مع الفلزات القلوية بحذر. يمكنها أن تشتعل تلقائيًا في الهواء وتتفاعل بشكل انفجاري مع الماء، مما يؤدي إلى إطلاق غاز الهيدروجين. [2]
المجموعة 2: المعادن الأرضية القلوية
تُعرف المجموعة الثانية من الجدول الدوري باسم ” الفلزات القلوية الترابية “. تضم هذه المجموعة ستة عناصر: البريليوم والمغنيسيوم والكالسيوم والسترونتيوم والباريوم والراديوم.
تسمى هذه المعادن “قلوية” لأنها تتفاعل مع الماء لتكوين محاليل قلوية (قاعدية) .
تتمتع المعادن الأرضية القلوية بخصائص مماثلة، بما في ذلك درجات الانصهار والغليان العالية، والكثافة المنخفضة، والقدرة على تكوين الأيونات بسهولة بشحنة +2.
كما أنها شديدة التفاعل، خاصة مع الماء والأكسجين. ومع ذلك، على عكس الفلزات القلوية من المجموعة 1، فهي أقل تفاعلاً ولها نقطة انصهار أعلى.
توجد هذه العناصر في العديد من الأشياء اليومية، بما في ذلك العظام (الكالسيوم)، والألعاب النارية (السترونتيوم)، وأجزاء الطائرات (المغنيسيوم).
وتستخدم المعادن الأرضية القلوية أيضًا في العمليات الصناعية، مثل إنتاج الألومنيوم والصلب.
المجموعة 3 – 11: المعادن الانتقالية
تُعرف المجموعة من 3 إلى 11 من الجدول الدوري بالمجموعة المعدنية الانتقالية . تتمتع هذه المعادن بخصائص فريدة تميزها عن العناصر الأخرى الموجودة على الطاولة.
إحدى الخصائص المميزة للمعادن الانتقالية هي قدرتها على تكوين مركبات ملونة.
ويرجع ذلك إلى تكويناتها الإلكترونية الفريدة، والتي تسمح لها بامتصاص وعكس أطوال موجية معينة من الضوء. [3]
تُعرف المعادن الانتقالية أيضًا بنقاط انصهارها وغليانها العالية، فضلاً عن قوتها ومتانتها.
وغالبا ما تستخدم في مواد البناء والأسلاك الكهربائية وحتى المجوهرات.
المجموعة 13: مجموعة البورون
تُعرف المجموعة 13 من الجدول الدوري باسم مجموعة البورون، وتتضمن عناصر البورون (B)، والألومنيوم (Al)، والغاليوم (Ga)، والإنديوم (In)، والثاليوم (Tl)، والنيهونيوم (Nh).
تشترك هذه العناصر في خصائص معينة تجعلها متشابهة كيميائيا.
البورون هو المعدن الوحيد في هذه المجموعة، مما يعني أنه يحتوي على خصائص معدنية وغير معدنية .
المجموعة 14: مجموعة الكربون
تُعرف المجموعة 14 من الجدول الدوري باسم مجموعة الكربون، وتتضمن الكربون (C)، والسيليكون (Si)، والجرمانيوم (Ge)، والقصدير (Sn)، والرصاص (Pb)، والفليروفيوم (Fl).
هذه العناصر لها خصائص متشابهة لأنها تحتوي جميعها على أربعة إلكترونات تكافؤ.
يعد الكربون عنصرًا مهمًا جدًا لأنه يشكل الأساس لجميع الجزيئات العضوية، بما في ذلك العناصر الأساسية للحياة مثل البروتينات والحمض النووي. [4]
المجموعة 15: البنكتوجينات
تُعرف المجموعة 15 من الجدول الدوري أيضًا بمجموعة النيتروجين (أو البنكتوجينات).
تحتوي هذه المجموعة على 6 عناصر: النيتروجين (N)، الفوسفور (P)، الزرنيخ (As)، الأنتيمون (Sb)، البزموت (Bi) والموسكوفيوم (Mc).
تحتوي عناصر المجموعة 15 على خمسة إلكترونات تكافؤ في غلافها الإلكتروني الخارجي، مما يعني أنها تميل إلى تكوين ثلاث روابط تساهمية لإكمال الثماني.
كما أنها تميل إلى اكتساب ثلاثة إلكترونات لتكوين الأنيونات . تصبح العناصر أقل غير معدنية وأكثر معدنية في المجموعة.
المجموعة 16: الكالكوجينات
تُعرف المجموعة 16 من الجدول الدوري بمجموعة الأكسجين. وتشمل عناصر الأكسجين (O)، والكبريت (S)، والسيلينيوم (Se)، والتيلوريوم (Te)، والبولونيوم (Po)، والكبد (Lv).
تشترك هذه العناصر في خصائص معينة، بما في ذلك وجود ستة إلكترونات تكافؤ في مستوى الطاقة الخارجي لها.
ويعد الأكسجين العنصر الأكثر وفرة في هذه المجموعة وهو ضروري للحياة، فهو مكون أساسي للمياه والعديد من الجزيئات العضوية.
يمكن للعناصر الموجودة في مجموعة الأكسجين أن تشكل مركبات مع العديد من العناصر الأخرى، بما في ذلك المعادن واللافلزات .
المجموعة 17: الهالوجينات
تُعرف المجموعة 17 من الجدول الدوري أيضًا بمجموعة الهالوجين . ويتكون من ستة عناصر: الفلور والكلور والبروم واليود والأستاتين والتينيسين.
تحتوي جميع الهالوجينات على سبعة إلكترونات في غلافها الخارجي، المعروف أيضًا باسم غلاف التكافؤ. وهذا يجعلها شديدة التفاعل، حيث أنها تحتاج فقط إلى إلكترون إضافي واحد لإكمال غلافها الخارجي وتصبح مستقرة.
من الخصائص المهمة الأخرى للهالوجينات أنها كلها غير معدنية، مما يعني أنها لا توصل الكهرباء وليست قابلة للطرق أو السحب مثل المعادن.
كما أنها توجد أيضًا في الحالات الثلاث للمادة في درجة حرارة الغرفة، حيث يكون الفلور والكلور غازين، والبروم سائلًا، واليود والأستاتين مواد صلبة.
المجموعة 18: الغازات النادرة
تُعرف المجموعة 18 من الجدول الدوري أيضًا بالغازات النبيلة .
تشمل الغازات النبيلة الهيليوم (He)، والنيون (Ne)، والأرجون (Ar)، والكريبتون (Kr)، والزينون (Xe)، والرادون (Rn).
وتسمى هذه الغازات بالغازات النبيلة لأنها مستقرة جدًا ولا تتفاعل بسهولة مع العناصر الأخرى.
تقع الغازات النبيلة في العمود الموجود في أقصى يمين الجدول الدوري، وتمتلك جميعها غلافًا خارجيًا ممتلئًا بالإلكترونات، مما يجعلها غير متفاعلة على الإطلاق.
كما أنها عديمة الرائحة وعديمة اللون ولها نقاط غليان وانصهار منخفضة.
