كلوريد الكبريتيل (SO2Cl2) هو مركب يتكون من اتحاد ثاني أكسيد الكبريت والكلور. يتم استخدامه ككاشف في التفاعلات الكيميائية وكمبخر لمكافحة الآفات.
| اسم الأيوباك | كلوريد السلفوريل |
| الصيغة الجزيئية | SO2Cl2 |
| CAS رقم | 7791-25-5 |
| المرادفات | ثنائي كلوريد الكبريت، أوكسي كلوريد الكبريت، أكسيد ثنائي كلوريد الكبريت |
| إنتشي | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
خصائص كلوريد السلفوريل
صيغة كلوريد السلفوريل
الصيغة الكيميائية لثاني كلوريد الكبريتيك هي SO2Cl2. وهو مشتق من اتحاد ذرة كبريت واحدة وذرتين أكسجين وذرتين كلور. تمثل هذه الصيغة تركيب وترتيب الذرات في جزيء ثاني كلوريد الكبريتيك.
كلوريد السلفوريل الكتلة المولية
يمكن حساب الكتلة المولية لثنائي كلوريد الكبريتيك عن طريق إضافة الكتل الذرية للعناصر المكونة له. يحتوي ثاني كلوريد الكبريتيك على كتلة مولية تبلغ حوالي 134.97 جرامًا لكل مول. هذه القيمة مهمة للحسابات المختلفة للتفاعلات الكيميائية وقياس العناصر الكيميائية.
نقطة غليان كلوريد السلفوريل
تبلغ درجة غليان ثاني كلوريد الكبريتيك حوالي 69 درجة مئوية. عندما ترتفع درجة الحرارة فوق هذه النقطة، يخضع ثاني كلوريد الكبريتيك لتغير طوري، ويتحول من سائل إلى غاز. تعتبر نقطة الغليان معلمة حاسمة في تحديد الظروف التي يمكن في ظلها استخدام ثنائي كلوريد الكبريتيك أو التعامل معه.
نقطة انصهار كلوريد السلفوريل
تبلغ نقطة انصهار ثاني كلوريد الكبريتيك حوالي -54 درجة مئوية. عند درجات حرارة أقل من هذه النقطة، يتغير ثاني كلوريد الكبريتيك من الحالة الصلبة إلى الحالة السائلة. تعد نقطة الانصهار مهمة لتخزين ومعالجة ثاني كلوريد الكبريتيك لأنها تشير إلى الظروف التي يصلب فيها أو يسيل.
كثافة كلوريد السلفوريل جم/مل
تبلغ كثافة ثاني كلوريد الكبريتيك حوالي 1.638 جرام لكل مليلتر (جم / مل). تمثل الكثافة كتلة المادة لكل وحدة حجم وتساعد في تحديد سلوكها الجسدي. تعد كثافة ثاني كلوريد الكبريتيك مهمة لفهم طفوه وذوبانه وتوافقه مع المواد الأخرى.
الوزن الجزيئي لكلوريد السلفوريل
يبلغ الوزن الجزيئي لثاني كلوريد الكبريتيك حوالي 134.97 وحدة كتلة ذرية (u). هو مجموع الكتل الذرية للذرات المكونة لجزيء ثاني كلوريد الكبريتيك. يوفر الوزن الجزيئي معلومات مهمة لمختلف الحسابات الكيميائية ولتحديد كمية المادة في عينة معينة.
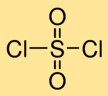
هيكل كلوريد السلفوريل
يحتوي ثنائي كلوريد الكبريتيك على بنية جزيئية تكون فيها ذرة كبريت مرتبطة بشكل مزدوج بذرتي أكسجين ورابطة فردية مع ذرتين من ذرات الكلور. يشكل هذا الترتيب ذرة كبريت مركزية محاطة بذرات الأكسجين والكلور، مما يعطي ثنائي كلوريد الكبريت بنيته المميزة.
ذوبان كلوريد السلفوريل
ثنائي كلوريد الكبريتيك ضعيف الذوبان في الماء. يتفاعل مع الماء لينتج حمض الهيدروكلوريك وحمض الكبريتيك، مما يجعله متفاعلًا مائيًا. ومع ذلك، يظهر ثنائي كلوريد الكبريتيك بعض القابلية للذوبان في المذيبات العضوية مثل الهيدروكربونات المكلورة والمركبات العطرية، مما يجعلها مناسبة لتطبيقات معينة.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1,638 جم/مل |
| لون | لا يوجد |
| يشم | لاذع، خانق |
| الكتلة المولية | 134.97 جرام/مول |
| كثافة | 1,638 جم/مل |
| نقطة الانصهار | -54 درجة مئوية |
| نقطة الغليان | 69 درجة مئوية |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | يتفاعل بقوة |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل الهيدروكربونات المكلورة والمركبات العطرية |
| ضغط البخار | 43.6 ملم زئبق (عند 25 درجة مئوية) |
| كثافة بخار | 4.43 (الهواء = 1) |
| pKa | لا يوجد |
| الرقم الهيدروجيني | لا يوجد |
سلامة ومخاطر كلوريد السلفوريل
يشكل ثاني كلوريد الكبريت العديد من مخاطر السلامة ويجب اتخاذ الاحتياطات اللازمة عند التعامل معه. وهي مادة قابلة للتآكل يمكن أن تسبب حروقًا شديدة في الجلد والعينين والجهاز التنفسي عند ملامستها. قد يؤدي استنشاق أبخرةه بشكل مباشر إلى تهيج الجهاز التنفسي وتلف الرئة. يتفاعل بعنف مع الماء، ويطلق غازات سامة ويشكل خطر الانفجار. لذلك، من المهم التعامل مع ثاني كلوريد الكبريت في منطقة جيدة التهوية وارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية وحماية الجهاز التنفسي. يجب تنظيف الانسكابات على الفور باستخدام الإجراءات المناسبة وتخزينها في منطقة باردة وجافة بعيدًا عن المواد غير المتوافقة.
| رموز الخطر | تآكل (C)، أكسدة (O) |
| وصف الأمان | يسبب حروقا جلدية شديدة وتلفا للعين. يتفاعل بعنف مع الماء. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 1834 (ثنائي كلوريد الكبريت) |
| رمز النظام المنسق | 28121000 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | الثاني (خطر متوسط) |
| تسمم | سام جدا؛ ضار إذا ابتلع أو استنشاقها أو امتصاصها عن طريق الجلد. |
طرق تصنيع كلوريد السلفوريل
يستخدم الناس عادة بعض الطرق لتصنيع ثنائي كلوريد الكبريتيك.
تتضمن إحدى الطرق التفاعل بين ثاني أكسيد الكبريت (SO2) وغاز الكلور (Cl2) . في وجود محفز، مثل الكربون المنشط أو كلوريد الألومنيوم، تتفاعل الغازات لتكوين ثنائي كلوريد الكبريتيك (SO2Cl2). يحدث هذا التفاعل عادة عند درجات حرارة عالية، حوالي 100 إلى 200 درجة مئوية.
هناك طريقة أخرى لتصنيع ثاني كلوريد الكبريتيك تتضمن تفاعل ثالث أكسيد الكبريت (SO3) مع كلوريد الهيدروجين (HCl). وفي ظل ظروف خاضعة للرقابة، يتحد هذان المركبان لإنتاج ثنائي كلوريد الكبريت. هذا التفاعل طارد للحرارة ويحدث عادة في الطور الغازي.
تولد عملية كلوريد الثيونيل ثاني كلوريد الكبريتيك عن طريق تفاعل درجة حرارة الغرفة لحمض الكبريتيك (H2SO4) مع خماسي كلوريد الفوسفور (PCl5) . ينتج عن هذا التفاعل ثنائي كلوريد الكبريتيك وكذلك من منتجات مثل حمض الفوسفوريك (H3PO4) وكلوريد الهيدروجين (HCl). تستخدم البيئات الصناعية عادة هذه الطريقة.
ومن المهم أن نلاحظ أن أساليب التوليف هذه تتطلب معالجة دقيقة للكواشف والنظر في احتياطات السلامة بسبب التفاعل والطبيعة الخطرة للمواد المعنية.
بالإضافة إلى ذلك، غالبًا ما يستخدم الكيميائيون المعدات المناسبة، مثل المكثفات وأنظمة الارتجاع، للتحكم في ظروف التفاعل وضمان نجاح تخليق ثاني كلوريد الكبريت.
استخدامات كلوريد السلفوريل
يجد ثاني كلوريد الكبريتيك (SO2Cl2) تطبيقات مختلفة في صناعات مختلفة بسبب خصائصه الفريدة. فيما يلي بعض الاستخدامات الرئيسية لثنائي كلوريد الكبريتيك:
- الكاشف الكيميائي: يستخدم التخليق العضوي عادةً ثاني كلوريد الكبريتيك ككاشف كيميائي متعدد الاستخدامات، حيث يشارك بنشاط في تفاعلات مختلفة بما في ذلك الكلورة والسلفنة والأسترة، مما يسمح بإدخال وظائف الكلور أو الكبريت أو الحمض في المركبات العضوية.
- المبيدات الحشرية ومواد التبخير: يعمل ثاني كلوريد الكبريت كمادة تبخير قوية لمكافحة الآفات في الحبوب المخزنة ومطاحن الدقيق ومنشآت تجهيز الأغذية، مما يؤدي بشكل فعال إلى القضاء على الحشرات واليرقات والآفات التي يمكن أن تلحق الضرر بالمنتجات الزراعية المخزنة بسبب خصائصه كمبيد حيوي قوي.
- البلمرة: في بلمرة مونومرات معينة، مثل كلوريد الفينيل، يعمل ثنائي كلوريد الكبريت كمحفز نشط أو بادئ، مما يسهل إنتاج كلوريد البوليفينيل (PVC)، وهو بوليمر لدن بالحرارة يستخدم على نطاق واسع مع تطبيقات في صناعات البناء والسيارات والكهرباء.
- المستحضرات الصيدلانية: يلعب ثاني كلوريد الكبريت دورًا حاسمًا في تركيب المركبات الصيدلانية، وخاصة السلفوناميدات، وهي مضادات حيوية أساسية وعوامل علاجية تستخدم لعلاج الالتهابات المختلفة.
- صناعة الأصباغ: يشارك ثنائي كلوريد الكبريت بشكل فعال في إنتاج الأصباغ، وخاصة تلك التي تحتوي على الكبريت أو الكلور. إنه يقدم بنشاط المجموعات الوظيفية المطلوبة ويحسن ثبات اللون واستقرار الصبغة.
- الوسطيات الكيميائية: يعمل ثاني كلوريد الكبريتيك كوسيط نشط في تخليق المواد الكيميائية الأخرى، بما في ذلك ثاني أكسيد الكبريت، وحامض الكبريتيك، وكلوريدات السلفونيل، والتي تجد تطبيقات في العديد من الصناعات مثل إنتاج المنظفات وتصنيع البلاستيك والأدوية.
- معالجة المياه: لتنقية المياه وتطهيرها، يعمل ثنائي كلوريد الكبريتيك بشكل فعال على تحييد وإزالة البكتيريا الضارة والفيروسات والكائنات الحية الدقيقة الأخرى الموجودة في مصادر المياه.
- التطبيقات المخبرية: تستخدم الإجراءات المخبرية المختلفة ثنائي كلوريد الكبريتيك بشكل فعال، على سبيل المثال للكشف وتحديد الأمينات الأولية والثانوية. يتفاعل بنشاط مع الأمينات لتكوين السلفوناميدات المستقرة، مما يسهل تحليلها وتوصيفها.
أسئلة:
س: ما هو العدد الإجمالي لجزيئات الجرام من SO2Cl2 في 13.5 جم من كلوريد السلفوريل؟
ج: يمكن حساب إجمالي عدد جزيئات جرام SO2Cl2 في 13.5 جم من كلوريد السلفوريل عن طريق قسمة الكتلة المعطاة على الكتلة المولية لـ SO2Cl2.
س: هل SO2Cl2 قطبي أم غير قطبي؟
ج: SO2Cl2 هو جزيء قطبي بسبب وجود روابط قطبية وهندسة جزيئية غير متماثلة.
س: متى ينخفض ضغط SO2Cl2؟
ج: يعتمد انخفاض ضغط ثاني أكسيد الكبريت SO2Cl2 على عوامل مختلفة مثل درجة الحرارة والحجم وظروف التفاعل. لا يمكن تحديد ذلك بناءً على الوقت وحده.
س: ما هو الضغط الجزئي لـ SO2Cl2 في هذا الخليط؟
ج: يمكن تحديد الضغط الجزئي لـ SO2Cl2 في الخليط باستخدام قانون الغاز المثالي، اعتمادًا على درجة الحرارة والحجم والكسر المولي أو تركيز SO2Cl2.
س: ما نوع (أنواع) القوى الجزيئية المتوقعة بين جزيئات SO2Cl2؟
ج: تشمل القوى الجزيئية المتوقعة بين جزيئات SO2Cl التفاعلات ثنائية القطب وقوى التشتت في لندن.
س: عند أي نقطة سينخفض الضغط الجزئي لـ SO2Cl2 إلى عُشر قيمته الأولية؟
ج: إن الوقت اللازم لانخفاض الضغط الجزئي لـ SO2Cl2 إلى عُشر قيمته الأولية يعتمد على الظروف المحددة للنظام ومعدل التفاعل الكيميائي المعني.
س: ما هي الكتلة المولية لـ SO2Cl2؟
ج: تبلغ الكتلة المولية لـ SO2Cl2 حوالي 134.97 جرامًا لكل مول.
س: ما هي الهندسة الجزيئية لـ SO2Cl2؟
ج: الهندسة الجزيئية لـ SO2Cl2 منحنية أو على شكل حرف V، مع وجود ذرة كبريت في المنتصف مرتبطة بذرتي أكسجين وذرتين من ذرات الكلور.
س: ما هو تركيب لويس لـ SO2Cl2؟
ج: يتكون تركيب لويس من SO2Cl2 من ذرة كبريت مرتبطة بشكل مزدوج بذرة أكسجين ورابطة واحدة مع ذرة أكسجين أخرى، مع ذرتي كلور مرتبطتين بذرة الكبريت.
