كلوريد الزنك (ZnCl2) مركب بلوري أبيض. يتم استخدامه في التطبيقات الصناعية المختلفة مثل تدفق اللحام والتخليق الكيميائي والجلفنة. وهو قابل للذوبان جدا في الماء.
| اسم الأيوباك | كلوريد الزنك |
| الصيغة الجزيئية | ZnCl2 |
| CAS رقم | 7646-85-7 |
| المرادفات | زبدة الزنك؛ ثنائي كلوريد الزنك؛ كلوريد الزنك (II)؛ زبدة الزنك؛ CI77043 |
| إنتشي | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
خصائص كلوريد الزنك
صيغة كلوريد الزنك
الصيغة الكيميائية لثنائي كلوريد الزنك هي ZnCl2. ويتكون من ذرة زنك واحدة (Zn) وذرتين كلور (Cl). يشكل هذا المركب الأيوني مادة صلبة بلورية بيضاء ذات بنية مميزة.
كلوريد الزنك الكتلة المولية
تبلغ الكتلة المولية لثنائي كلوريد الزنك حوالي 136.29 جرامًا لكل مول (جم / مول). وهو مشتق من مجموع الكتل الذرية لذرة زنك واحدة وذرتين كلور.
نقطة غليان كلوريد الزنك
يحتوي ثنائي كلوريد الزنك على نقطة غليان عالية نسبيًا تبلغ حوالي 732 درجة مئوية (C) أو 1350 درجة فهرنهايت (F). عند درجة الحرارة هذه، يتغير من الحالة السائلة إلى الحالة الغازية.
نقطة انصهار كلوريد الزنك
تبلغ نقطة انصهار ثاني كلوريد الزنك حوالي 290 درجة مئوية (C) أو 554 درجة فهرنهايت (F). عند درجة الحرارة هذه، يتغير ثنائي كلوريد الزنك الصلب إلى الحالة السائلة.
كثافة كلوريد الزنك جم/مل
تبلغ كثافة ثاني كلوريد الزنك حوالي 2.91 جرام لكل ملليلتر (جم / مل) في درجة حرارة الغرفة. تصف هذه الخاصية كتلتها لكل وحدة حجم.
الوزن الجزيئي لكلوريد الزنك
يبلغ الوزن الجزيئي لثنائي كلوريد الزنك، محسوبًا من تركيبته الكيميائية، حوالي 136.29 جم/مول. تمثل هذه القيمة مجموع الأوزان الذرية للذرات المكونة لها.
هيكل كلوريد الزنك
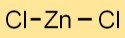
يحتوي ثنائي كلوريد الزنك على بنية شبكية بلورية تحتوي على كاتيونات Zn2+ وكلانيونات متماسكة معًا بواسطة روابط أيونية. يشكل الترتيب شبكة ثلاثية الأبعاد مستقرة ومنظمة.
ذوبان كلوريد الزنك
ثنائي كلوريد الزنك قابل للذوبان بشدة في الماء، مما يعني أنه يذوب بسهولة في وجود جزيئات الماء. تساهم هذه الخاصية في استخدامها على نطاق واسع في مختلف التطبيقات الصناعية والعمليات الكيميائية.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.91 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 136.29 جرام/مول |
| كثافة | 2.91 جم/سم3 |
| نقطة الانصهار | 290 درجة مئوية (554 درجة فهرنهايت) |
| نقطة الغليان | 732 درجة مئوية (1350 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل الكحول والأسيتون |
| ضغط البخار | 1 ملم زئبق عند 359 درجة مئوية |
| كثافة بخار | 5.4 (الهواء = 1) |
| pKa | -1.9 |
| الرقم الهيدروجيني | ~5 (محلول 0.1 م في الماء) |
سلامة ومخاطر كلوريد الزنك
يشكل ثاني كلوريد الزنك بعض مخاطر السلامة التي تتطلب معالجة دقيقة. الاتصال المباشر مع الجلد أو العينين قد يسبب تهيجًا وحروقًا. استنشاق أبخرةه قد يهيج الجهاز التنفسي. ومن الضروري ارتداء معدات الحماية مثل القفازات والنظارات الواقية عند التعامل مع المركب. بالإضافة إلى ذلك، يجب تخزينه في منطقة جيدة التهوية، بعيدًا عن المواد غير المتوافقة. في حالة الابتلاع أو التعرض العرضي، اطلب العناية الطبية على الفور. تجنب إطلاقه في البيئة، لأنه قد يكون ضارًا بالحياة المائية. من خلال اتباع تدابير السلامة والمبادئ التوجيهية المناسبة، يمكن التقليل من المخاطر المرتبطة بثاني كلوريد الزنك بشكل فعال.
| رموز الخطر | تآكل (ج)؛ ضار (Xn) |
| وصف الأمان | تجنب ملامسة الجلد والعينين. استخدام في منطقة جيدة التهوية. ارتداء القفازات والنظارات الواقية. في حالة ملامسته أو ابتلاعه، يجب استشارة الطبيب. لا تطلق في البيئة. الابتعاد عن المواد غير المتوافقة. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 2331 (ثنائي كلوريد الزنك اللامائي)؛ رقم الأمم المتحدة 2332 (ثنائي كلوريد الزنك، محلول) |
| رمز النظام المنسق | 28273990 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | الثاني (خطر متوسط) |
| تسمم | ضار إذا ابتلع أو استنشق. |
طرق تصنيع كلوريد الزنك
طرق مختلفة تسمح بتخليق ثاني كلوريد الزنك.
يتضمن النهج الشائع تفاعل أكسيد الزنك (ZnO) مع حمض الهيدروكلوريك (HCl) . في هذه الطريقة، يضيف الكيميائي أكسيد الزنك ببطء إلى محلول حمض الهيدروكلوريك مع التحريك المستمر. ينتج عن التفاعل ثنائي كلوريد الزنك والماء كمنتجات ثانوية. هناك طريقة أخرى وهي الجمع المباشر بين معدن الزنك وغاز الكلور (Cl2). يتطلب هذا التفاعل التحكم الدقيق في درجة الحرارة والضغط لضمان نتيجة ناجحة.
تتضمن العملية البديلة إذابة معدن الزنك في محلول حمض الهيدروكلوريك، مما يؤدي إلى تكوين ثنائي كلوريد الزنك وغاز الهيدروجين (H2). معالجة حمض الهيدروكلوريك مع كربونات الزنك (ZnCO3) أو هيدروكسيد الزنك (Zn(OH)2) ينتج ثنائي كلوريد الزنك والماء وثاني أكسيد الكربون (CO2) كمنتجات ثانوية.
تخضع كبريتات الزنك (ZnSO4) وكلوريد الباريوم (BaCl2) لتفاعل تحلل مزدوج لإنتاج ثنائي كلوريد الزنك بالإضافة إلى تكوين كبريتات الباريوم (BaSO4). وبخلط هذين المركبين، يترسب ثنائي كلوريد الزنك، بينما تبقى كبريتات الباريوم (BaSO4) في المحلول.
توفر كل طريقة من هذه الطرق طريقًا لتخليق ثاني كلوريد الزنك ويعتمد اختيار الطريقة على عوامل مثل توفر الكواشف وظروف التفاعل والنقاء المطلوب للمنتج النهائي.
استخدامات كلوريد الزنك
يجد ثنائي كلوريد الزنك مجموعة واسعة من التطبيقات في مختلف الصناعات بسبب خصائصه المتنوعة. فيما يلي بعض الاستخدامات المهمة لثنائي كلوريد الزنك:
- الجلفنة: يلعب ثاني كلوريد الزنك دورًا أساسيًا في عملية الجلفنة لمنع تآكل المعادن مثل الفولاذ والحديد. فهو يشكل طبقة واقية من الزنك، مما يحسن طول العمر والمتانة.
- تدفق اللحام: في عمليات اللحام بالنحاس، يعمل ثنائي كلوريد الزنك كتدفق لإزالة أكاسيد المعادن من سطح المعادن، مما يوفر التصاق أفضل ورابطة قوية بين اللحام والمعدن.
- التخليق الكيميائي: يعمل كمحفز أو كاشف في العديد من التفاعلات الكيميائية، مثل الأسلة وجفاف فريدل كرافت.
- الحفاظ على الخشب: تستخدم تطبيقات حفظ الخشب ثاني كلوريد الزنك لحماية الخشب من العفن الفطري والحشرات، مما يطيل عمره.
- معالجة المنسوجات: في صناعة النسيج، يسهل إنتاج الأقمشة القطنية المرسيرة، مما يضفي خصائص مرغوبة مثل زيادة اللمعان وتحسين القوة.
- إلكتروليت البطارية: يعمل ثنائي كلوريد الزنك كإلكتروليت في بعض البطاريات، مثل بطارية الزنك والكربون، مما يساعد على تسهيل تدفق الأيونات بين الأقطاب الكهربائية.
- مزيل العرق ومضاد التعرق: وهو مكون شائع في مضادات التعرق بسبب خصائصه القابضة التي تساعد على تقليل إنتاج العرق والتحكم في رائحة الجسم.
- المستحضرات الصيدلانية: يُستخدم ثنائي كلوريد الزنك في العديد من التركيبات الصيدلانية، خاصة في غسولات الفم وأقراص الحلق والمحاليل المطهرة الموضعية.
- صناعة الصباغة: تستخدم صناعة الصباغة ثاني كلوريد الزنك كمادة لاذعة في عملية الصباغة لتحسين ثبات لون الأقمشة ذات الأصباغ.
- التركيبات اللاصقة: يقوم المصنعون بدمج ثنائي كلوريد الزنك في تركيبات لاصقة لتحسين خصائص الترابط للمواد اللاصقة والأسمنت.
إن تعدد استخدامات ثاني كلوريد الزنك يجعله مركبًا أساسيًا في العديد من العمليات الصناعية والمنتجات اليومية، مما يساهم في تقدم العديد من الصناعات الرئيسية.
أسئلة:
س: هل ZnCl2 قابل للذوبان في الماء؟
ج: نعم، ZnCl2 شديد الذوبان في الماء.
س: ما المعادلة الأيونية الصافية لتفاعل ZnCl2 مع NaOH؟
ج: المعادلة الأيونية الصافية هي Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s).
س: هل ZnCl2 قابل للذوبان؟
ج: نعم، ZnCl2 قابل للذوبان في الماء.
س: هل ZnCl2 أيوني أم جزيئي؟
ج: ZnCl2 مركب أيوني.
س: ما نوع الرابطة التي تحدث في كلوريد الزنك الثنائي ZnCl2؟
ج: يحدث الارتباط الأيوني في ZnCl2.
س: ما التغير الذي يمكن أن يؤدي إلى انخفاض معدل إنتاج ZnCl2؟
ج: يمكن أن يؤدي خفض درجة حرارة التفاعل إلى تقليل معدل إنتاج ZnCl2.
س: هل ZnCl2 صلب؟
ج: نعم، ZnCl2 مادة صلبة في درجة حرارة الغرفة.
س: هل ZnCl2 ملح؟
ج: نعم يعتبر ZnCl2 ملحاً.
س: كيف تحصل على كلوريد الزنك من الزنك؟
ج: تفاعل الزنك مع حمض الهيدروكلوريك ينتج كلوريد الزنك.
س: ما هي صيغة كلوريد الزنك؟
ج: صيغة كلوريد الزنك هي ZnCl2.
س: هل بطاريات كلوريد الزنك ضارة بالأرض؟
ج: نعم، يمكن أن تكون بطاريات كلوريد الزنك ضارة بالبيئة إذا لم يتم التخلص منها بشكل صحيح.
س: ما هي الكتلة المولية لكلوريد الزنك؟
ج: تبلغ الكتلة المولية لكلوريد الزنك حوالي 136.29 جم/مول.
