كلوريد الثيونيل مركب كيميائي يستخدم في التطبيقات الصناعية المختلفة. يتفاعل مع الكحوليات والأحماض الكربوكسيلية، وينتج الكلوريدات المقابلة وكلوريد السلفوريل، على التوالي.
| اسم الأيوباك | كلوريد الثيونيل |
| الصيغة الجزيئية | SOCl₂ |
| CAS رقم | 7719-09-7 |
| المرادفات | ثنائي كلوريد الكبريت، أوكسي كلوريد الكبريت، ثنائي كلوريد الثيونيل |
| إنتشي | إنتشي = 1S/Cl2OS/c1-4(2)3 |
خصائص كلوريد الثيونيل
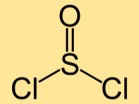
صيغة كلوريد الثيونيل
صيغة ثنائي كلوريد الثيونيل هي SOCl₂، والتي تمثل ذرة كبريت واحدة مرتبطة بذرتين من ذرات الكلور. وهو مركب كيميائي يستخدم على نطاق واسع في مختلف الصناعات.
كلوريد الثيونيل الكتلة المولية
يحتوي ثنائي كلوريد الثيونيل على كتلة مولية تبلغ حوالي 118.97 جرامًا لكل مول. يتم تحديد الكتلة المولية عن طريق إضافة الكتل الذرية للعناصر المكونة لها.
نقطة غليان كلوريد الثيونيل
تبلغ درجة غليان ثنائي كلوريد الثيونيل حوالي 79.6 درجة مئوية. هذه هي درجة الحرارة التي يتغير عندها الشكل السائل لثنائي كلوريد الثيونيل إلى الحالة الغازية.
نقطة انصهار كلوريد الثيونيل
تبلغ نقطة انصهار ثنائي كلوريد الثيونيل حوالي -104.5 درجة مئوية. هذه هي درجة الحرارة التي يتغير عندها الشكل الصلب لثنائي كلوريد الثيونيل إلى الحالة السائلة.
كثافة كلوريد الثيونيل جم/مل
تبلغ كثافة ثنائي كلوريد الثيونيل حوالي 1.64 جرام لكل مليلتر. الكثافة هي مقياس الكتلة لكل وحدة حجم وهي خاصية مهمة للمادة.
الوزن الجزيئي لكلوريد الثيونيل
يبلغ الوزن الجزيئي لثنائي كلوريد الثيونيل حوالي 118.97 جرامًا لكل مول. ويتم حسابه عن طريق إضافة الأوزان الذرية للكبريت والكلور والأكسجين.
هيكل كلوريد الثيونيل
يتكون هيكل ثنائي كلوريد الثيونيل من ذرة كبريت مرتبطة بذرتين من الكلور. يتم ترتيب ذرات الكبريت والكلور خطيًا لتشكل جزيءًا منحني الشكل.
ذوبان كلوريد الثيونيل
ثنائي كلوريد الثيونيل قليل الذوبان في الماء ولكنه يذوب بسهولة في المذيبات العضوية مثل البنزين والتولوين ورابع كلوريد الكربون. ذوبانه هو عامل مهم في تطبيقاته.
| مظهر | عديم اللون إلى سائل أصفر شاحب |
| جاذبية معينة | 1,638 جم/مل |
| لون | عديم اللون |
| يشم | لاذع، خانق |
| الكتلة المولية | 118.97 جرام/مول |
| كثافة | 1,638 جم/مل |
| نقطة الانصهار | -104.5 درجة مئوية |
| نقطة الغليان | 79.6 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل بعنف |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل البنزين والتولوين ورابع كلوريد الكربون |
| ضغط البخار | 4.33 كيلو باسكال عند 20 درجة مئوية |
| كثافة بخار | 3.9 (الهواء = 1) |
| pKa | -6.3 |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر كلوريد الثيونيل
يشكل ثنائي كلوريد الثيونيل العديد من مخاطر السلامة ويجب التعامل معه بحذر. وهو شديد التآكل ويمكن أن يسبب حروقًا شديدة عند ملامسته للجلد أو العينين أو الأغشية المخاطية. استنشاق أبخرةه قد يسبب تهيجاً وتلفاً في الجهاز التنفسي. يتفاعل المركب بعنف مع الماء، ويطلق غازات سامة، مثل كلوريد الهيدروجين. ولذلك يجب تخزينها والتعامل معها بعيدا عن مصادر الرطوبة. يتفاعل ثنائي كلوريد الثيونيل أيضًا بقوة مع الكحوليات والمركبات المحتوية على الماء، مما قد يؤدي إلى مخاطر الحريق أو الانفجار. تعد التهوية الكافية ومعدات الحماية الشخصية وممارسات التخزين المناسبة ضرورية لضمان التعامل الآمن مع ثنائي كلوريد الثيونيل.
| رموز الخطر | أكالة (C)، سامة (T)، خطرة على البيئة (N) |
| وصف الأمان | – يُحفظ بعيدًا عن مصادر الرطوبة والمواد غير المتوافقة.<br>- يستخدم في منطقة جيدة التهوية ويرتدي معدات الحماية الشخصية المناسبة.<br>- يجب التعامل معه بحذر لتجنب ملامسة الجلد والعينين والأغشية المخاطية.<br> – يحفظ في علبة محكمة الغلق في مكان بارد وجاف. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 1836 (ثنائي كلوريد الثيونيل) |
| رمز النظام المنسق | 2812.10.00 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | الثاني (خطير إلى حد ما) |
| تسمم | شديد السمية عند الاستنشاق والابتلاع وامتصاص الجلد.<br>- قد يسبب حروقًا شديدة وتهيجًا في الجهاز التنفسي.<br>- قد يسبب آثارًا ضارة طويلة المدى على الكائنات المائية. |
طرق تصنيع كلوريد الثيونيل
تسمح الطرق المختلفة بتخليق ثنائي كلوريد الثيونيل.
يتضمن النهج الشائع التفاعل بين ثالث أكسيد الكبريت (SO₃) وثاني كلوريد الكبريت (SCl₂) في وجود محفز مثل الكربون المنشط أو كلوريد الألومنيوم . يحدث التفاعل عند درجات حرارة عالية، عادة حوالي 300 إلى 400 درجة مئوية، وبالتالي ينتج ثنائي كلوريد الثيونيل.
تتضمن الطريقة الأخرى التفاعل المباشر لثاني أكسيد الكبريت (SO₂) مع خماسي كلوريد الفوسفور (PCl₅) أو أوكسي كلوريد الفوسفور (POCl₃). يحدث هذا التفاعل عند الارتجاع، مع الإضافة التدريجية للكواشف، ويؤدي إلى ثنائي كلوريد الثيونيل.
تفاعل الكبريت مع ثلاثي كلوريد الفوسفور (PCl₃) يعطي ثنائي كلوريد الثيونيل. تتضمن هذه العملية تسخين المواد المتفاعلة والسماح بتكوين ثنائي كلوريد الثيونيل.
تتضمن الطريقة الأخرى التفاعل بين خماسي كبريتيد الفوسفور (P₂S₅) وخماسي كلوريد الفوسفور (PCl₅) في وجود محفز حمض لويس مثل كلوريد الألومنيوم. يحدث التفاعل عند درجات حرارة عالية وينتج عنه تكوين ثنائي كلوريد الثيونيل.
من المهم أن نلاحظ أن أساليب التوليف هذه تتطلب احتياطات السلامة والتعامل السليم بسبب الطبيعة الخطرة للكواشف المعنية. يتطلب التركيب الآمن والفعال لثنائي كلوريد الثيونيل خبرة الكيميائيين ذوي الخبرة واستخدام المعدات المخبرية المناسبة.
استخدامات كلوريد الثيونيل
يجد ثنائي كلوريد الثيونيل تطبيقات واسعة في مختلف الصناعات بسبب خصائصه الكيميائية المتنوعة. فيما يلي بعض الاستخدامات الشائعة لثنائي كلوريد الثيونيل:
- تحويل الأحماض الكربوكسيلية: يحول ثنائي كلوريد الثيونيل الأحماض الكربوكسيلية إلى كلوريدات الأسيل، وذلك باستخدام تفاعل فيلسمير-هاك إلى حد كبير في التخليق العضوي.
- كلورة الكحول: يتفاعل ثنائي كلوريد الثيونيل مع الكحوليات، مكونًا كلوريدات الألكيل ويستخدم في إنتاج المركبات المكلورة للأدوية والكيماويات الزراعية، المعروف باسم تفاعل دارزينز.
- عامل التجفيف: يعمل ثنائي كلوريد الثيونيل كعامل تجفيف، مما يسهل إزالة المركبات المختلفة من الماء. ويشيع استخدامه في تركيب الأصباغ والعطور والوسائط الصيدلانية.
- تصنيع بطاريات ليثيوم أيون: يستخدم المصنعون ثنائي كلوريد الثيونيل لإنتاج بطاريات ثنائي كلوريد الليثيوم ثيونيل، التي تتميز بكثافة طاقة عالية وعمر افتراضي طويل. ولهذه البطاريات تطبيقات في الأجهزة الطبية والمعدات العسكرية وأجهزة الاستشعار عن بعد.
- تفاعلات البلمرة: يشارك ثنائي كلوريد الثيونيل في تفاعلات البلمرة، مما يساهم في تخليق البوليمرات المختلفة، بما في ذلك البولي كربونات والبولي أنهيدريد.
- مركبات الفوسفور: يتفاعل ثنائي كلوريد الثيونيل مع مركبات الفوسفور، مثل ثلاثي كلوريد الفوسفور، وينتج كلوريد الفوسفوريل. يستخدم الكيميائيون هذه الوسائط لتصنيع مركبات الفوسفات العضوية ومثبطات اللهب.
- الكاشف الكيميائي: يعمل ثنائي كلوريد الثيونيل ككاشف متعدد الاستخدامات في العديد من التحولات الكيميائية، بما في ذلك الأسترة، والهلجنة، وتفاعلات الاستبدال النيوكليوفيلية.
أسئلة:
س: ما الذي يمكنك شطف كلوريد الثيونيل به؟
ج: يمكن شطف ثنائي كلوريد الثيونيل بكمية كبيرة من الكحول أو قاعدة متوافقة، مثل الميثانول أو محلول بيكربونات الصوديوم.
س: ما هو ناتج حمض الفاليريك مع كلوريد الثيونيل؟
ج: تفاعل حمض الفاليريك مع ثنائي كلوريد الثيونيل ينتج كلوريد فاليريل، بالإضافة إلى غاز ثاني أكسيد الكبريت.
س: هل يمكن إضافة كلوريد الثيونيل مع الحمض الكربوكسيلي؟
ج: نعم، يمكن إضافة ثنائي كلوريد الثيونيل إلى حمض كربوكسيلي لتحويله إلى كلوريد الأسيل بواسطة تفاعل فيلسماير-هاك.
س: أي مما يلي يمثل صيغة لويس الصحيحة لكلوريد الثيونيل (SOCl2)؟
ج: صيغة لويس الصحيحة لثنائي كلوريد الثيونيل (SOCl2) ممثلة بـ S=O | الكلور – الكلور.
س: ما الذي يحرك تفاعل كلوريد الثيونيل؟
ج: إن تفاعل ثنائي كلوريد الثيونيل يحركه التفاعل العالي لكلوريد الثيونيل، الذي يعمل كمحب للكهرباء في التحولات الكيميائية المختلفة.
س: كيف يتم إطفاء كلوريد الثيونيل؟
ج: يمكن إخماد ثنائي كلوريد الثيونيل عن طريق إضافة عامل إخماد مناسب مثل كحول أولي أو ثانوي، أو عن طريق تحلله بالماء بعناية.
س: ما الذي ستحصل عليه إذا قمت بخلط الأمينات مع كلوريد الثيونيل؟
ج: يؤدي خلط الأمينات مع ثنائي كلوريد الثيونيل إلى تكوين أملاح هيدروكلوريد الأمين المقابلة.
س: ما هو كلوريد الثيونيل؟
ج: ثنائي كلوريد الثيونيل مركب كيميائي له الصيغة SOCl2، ويشيع استخدامه ككاشف في التخليق العضوي وكعامل تجفيف.
س: ماذا سيفعل كلوريد الثيونيل الزائد؟
ج: يمكن أن يسبب ثنائي كلوريد الثيونيل المفرط تفاعلات قوية، مما قد يؤدي إلى إنتاج غازات سامة أو مخاطر انفجار، ويجب التعامل معه بحذر.
س: كيفية تحييد كلوريد الثيونيل؟
ج: يمكن معادلة ثنائي كلوريد الثيونيل عن طريق إضافته بعناية إلى كمية زائدة كبيرة من قاعدة مناسبة، مثل بيكربونات الصوديوم أو هيدروكسيد الصوديوم، مع ضمان احتياطات السلامة المناسبة.
