كلورات البوتاسيوم (KClO3) مركب كيميائي يتكون من البوتاسيوم والكلور والأكسجين. ويشيع استخدامه في صناعة أعواد الثقاب والمتفجرات والألعاب النارية بسبب خصائصه المؤكسدة.
| اسم الأيوباك | كلوريد البوتاسيوم |
| الصيغة الجزيئية | كلوريد البوتاسيوم3 |
| CAS رقم | 3811-04-9 |
| المرادفات | كلورات الكالسيوم، الكلوركاليك، كلورات البوتاسيوم، بيركلورات البوتاسيوم، رقم الأمم المتحدة 1485، كلورات البوتاسيوم، بيركلوريك الكالسيوم |
| إنتشي | InChI=1S/ClH3KO3/c2-1(3)4/h(H3,2,3,4)/p-1 |
خصائص كلورات البوتاسيوم
صيغة كلورات البوتاسيوم
لكلورات البوتاسيوم الصيغة الكيميائية KClO3، مما يدل على أنها تتكون من ذرة بوتاسيوم واحدة، وذرة كلور واحدة، وثلاث ذرات أكسجين. وهو مركب أيوني يتشكل عندما تتحد أيونات K+ و ClO3- عبر رابطة أيونية. المركب شديد التفاعل بسبب وجود الأكسجين، مما يمنحه خصائص مؤكسدة قوية.
كلورات البوتاسيوم الكتلة المولية
الكتلة المولية لـ KClO3 هي 122.55 جم/مول. وهو مجموع الكتل الذرية للعناصر الفردية التي يتكون منها المركب، وهي البوتاسيوم والكلور والأكسجين. تعد الكتلة المولية معلمة مهمة في الكيمياء لأنها تستخدم لحساب كتلة المادة اللازمة لإنتاج كمية معينة من المنتج في التفاعل الكيميائي.
نقطة غليان كلورات البوتاسيوم
ليس لدى KClO3 نقطة غليان محددة جيدًا لأنه يتحلل قبل الوصول إلى نقطة الغليان. عند تسخينه، فإنه يتحلل إلى كلوريد البوتاسيوم وغاز الأكسجين. لذلك، يخضع KClO3 لتفاعل تحلل حراري بدلاً من نقطة الغليان.
نقطة انصهار كلورات البوتاسيوم
نقطة انصهار KClO3 هي 356 درجة مئوية (673 درجة فهرنهايت). عند درجة الحرارة هذه، يذوب المركب الصلب ويتحول إلى سائل. تعتبر نقطة الانصهار خاصية أساسية للمركب لأنها تؤثر على السلوك الفيزيائي للمادة، بما في ذلك ذوبانها وكثافتها.
كثافة كلورات البوتاسيوم جم/مل
تبلغ كثافة KClO3 2.32 جم/مل عند درجة حرارة الغرفة. وهذا يعني أن حجمًا معينًا من المركب له كتلة معينة، وهو أمر مفيد في تحديد كتلة المادة المطلوبة لتفاعل كيميائي معين. تؤثر كثافة KClO3 أيضًا على قابليته للذوبان في الماء، حيث تميل المركبات ذات الكثافة الأعلى إلى أن تكون أقل قابلية للذوبان في الماء.
كلورات البوتاسيوم الوزن الجزيئي
الوزن الجزيئي لـ KClO3 هو 122.55 جم/مول. وهو مجموع الأوزان الذرية للذرات المكونة له وهي البوتاسيوم والكلور والأكسجين. يعد الوزن الجزيئي معلمة أساسية في قياس العناصر الكيميائية لأنه يستخدم لحساب كميات المواد المتفاعلة والمنتجات في التفاعل الكيميائي.
هيكل كلورات البوتاسيوم
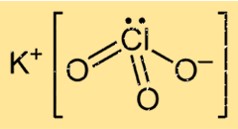
يمتلك KClO3 بنية بلورية في حالته الصلبة، تتكون من ذرات البوتاسيوم والكلور والأكسجين مرتبة في نمط محدد. يشكل المركب بنية شبكية بلورية مكعبة متمركزة الوجه، حيث يحاط كل أيون بوتاسيوم بست ذرات أكسجين وكل أيون أكسجين محاط بأربع ذرات بوتاسيوم وذرتين كلور.
ذوبان كلورات البوتاسيوم
KClO3 قابل للذوبان بشكل معتدل في الماء، مع ذوبان 7 جم / 100 مل من الماء في درجة حرارة الغرفة. تزداد قابلية ذوبان المركب مع درجة الحرارة، لأن جزيئات الماء لديها طاقة حركية أكبر ويمكنها إذابة المزيد من المركب. KClO3 قابل للذوبان أيضًا في المذيبات القطبية الأخرى مثل الإيثانول والأسيتون.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.32 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 122.55 جرام/مول |
| كثافة | 2.32 جم/سم3 |
| نقطة الانصهار | 356 درجة مئوية (673 درجة فهرنهايت) |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 7 جم / 100 مل عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 1.8 (كا = 1.6 × 10⁻⁵) |
| الرقم الهيدروجيني | الرقم الهيدروجيني لمحلول 0.1 م هو حوالي 6.5 إلى 7.5 |
سلامة ومخاطر كلورات البوتاسيوم
KClO3 مادة شديدة التفاعل ومن المحتمل أن تكون خطرة، لذا يجب التعامل معها بحذر شديد. يمكن أن يسبب تهيجًا خطيرًا للجلد والعين وقد يكون سامًا إذا تم ابتلاعه أو استنشاقه. عند تسخينها، يمكن أن تتفاعل بعنف وحتى تنفجر. يمكن أن يتفاعل KClO3 أيضًا بقوة مع مواد كيميائية أخرى، مثل حمض الكبريتيك والمركبات العضوية، وينتج غازات سامة مثل الكلور وثاني أكسيد الكلورات. من المهم اتباع بروتوكولات السلامة المناسبة عند العمل مع KClO3، بما في ذلك ارتداء معدات الحماية والعمل في منطقة جيدة التهوية.
| رموز الخطر | أو، شي، ن |
| وصف الأمان | تجنب ملامسة المواد القابلة للاشتعال. سامة إذا ابتلعتها. يسبب حروقا جلدية شديدة وتلفا للعين. |
| أرقام تعريف الأمم المتحدة | UN1485 |
| رمز النظام المنسق | 2829.90.10 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | سام جدا |
طرق تصنيع كلورات البوتاسيوم
هناك عدة طرق لتجميع KClO3.
تتضمن إحدى الطرق التفاعل بين كلوريد البوتاسيوم والمبيض. تتضمن هذه الطريقة إضافة محلول مبيض إلى محلول كلوريد البوتاسيوم وتقليب الخليط. للحصول على KClO3، قم بتصفية الراسب الناتج وغسله.
تتضمن الطريقة الأخرى التحليل الكهربائي لمحلول يحتوي على كلوريد البوتاسيوم والماء ومصدر للأكسجين. وتقوم خلية التحليل الكهربائي، وهي جهاز متخصص، بهذه العملية عن طريق فصل أيونات البوتاسيوم والكلوريد وإنتاج غاز الأكسجين. يتفاعل الأكسجين مع أيونات البوتاسيوم لتكوين KClO3.
تتضمن الطريقة الثالثة التفاعل بين هيدروكسيد البوتاسيوم وغاز الكلور، الذي ينتج عنه KClO3 مع كلوريد البوتاسيوم والماء. تتطلب هذه الطريقة مراقبة دقيقة لدرجة الحرارة وتركيز الكواشف لضمان الحصول على أفضل النتائج.
استخدامات كلورات البوتاسيوم
لدى KClO3 مجموعة واسعة من الاستخدامات في مختلف الصناعات، بما في ذلك:
- منتجات الألعاب النارية: يشيع استخدامها كعامل مؤكسد في الألعاب النارية وأجهزة الألعاب النارية الأخرى.
- أعواد الثقاب: تستخدم في رؤوس أعواد الثقاب الآمنة، والتي تشتعل عند اصطدامها بسطح خشن.
- الأسمدة: يستخدم كمصدر للبوتاسيوم للأسمدة النباتية.
- المبيض: يستخدم كعامل تبييض للمنسوجات والورق والمواد الأخرى.
- الكاشف المختبري: يستخدم أيضًا ككاشف مختبري للتفاعلات الكيميائية المختلفة.
- التطبيقات الطبية: يستخدم طبياً لعلاج أنواع معينة من الأمراض الجلدية، مثل الأكزيما.
- المتفجرات: عنصر شائع في بعض أنواع المتفجرات، مثل الصواعق والديناميت.
- المؤكسد: يستخدم كعامل مؤكسد في إنتاج بعض المواد الكيميائية، مثل البيركلورات.
أسئلة:
س: ما عدد جرامات كلوريد البوتاسيوم التي يتم إنتاجها إذا تحلل 25 جم من كلورات البوتاسيوم؟
ج: عندما يتحلل 25 جم من KClO3 فإنه ينتج 13.47 جم من كلوريد البوتاسيوم.
س: كيفية صنع كلورات البوتاسيوم؟
ج: يمكن تحضير KClO3 عن طريق تفاعل كلوريد البوتاسيوم مع المبيض، أو عن طريق التحليل الكهربائي لمحلول يحتوي على كلوريد البوتاسيوم، أو عن طريق تفاعل هيدروكسيد البوتاسيوم مع غاز الكلور.
س: ما عدد مولات الأكسجين الناتجة عندما يتحلل 2 مول من كلورات البوتاسيوم (kclo3)؟
ج: عندما يتحلل 2 مول من KClO3 فإنه ينتج 3 مول من غاز الأكسجين.
س: يحتوي محلول تركيزه 0.70 م على 3.0 جم من كلورات البوتاسيوم (kclo3). ما هو حجم الحل؟
ج: حجم المحلول 0.70 م الذي يحتوي على 3.0 جم من KClO3 هو 51.4 مل.
س: هل كلورات البوتاسيوم مادة متطايرة؟
ج: لا يعتبر KClO3 مادة متطايرة لأنه يحتوي على درجة انصهار وغليان عالية نسبيًا.
س: ما هي كمية kcl التي يتم إنتاجها إذا قمت بتحليل 2.50 جم من kclo3؟
ج: عندما يتحلل 2.50 جرام من KClO3 فإنه ينتج 1.35 جرام من كلوريد البوتاسيوم.
س: هل kclo3 قابل للذوبان في الماء؟
ج: نعم، KClO3 قابل للذوبان بدرجة عالية في الماء، مع قابلية ذوبان تبلغ 7 جم / 100 مل في درجة حرارة الغرفة.
س: ما عدد جرامات الأكسجين التي يمكن إنتاجها من تحلل 100 جرام من kclo3؟
ج: عندما يتحلل 100 جرام من KClO3 فإنه ينتج 45.02 جرام من غاز الأكسجين.
