تتكون كربونات النيكل (NiCO3) من أيونات النيكل وأيونات الكربونات. وهي مادة صلبة خضراء تستخدم في صناعة السيراميك والمحفزات بسبب خصائصها الفريدة.
| اسم الأيوباك | كربونات النيكل (II). |
| الصيغة الجزيئية | نيكو3 |
| CAS رقم | 3333-67-3 |
| المرادفات | كربونات النيكل؛ حمض الكربونيك، ملح النيكل، أحادي كربونات النيكل |
| إنتشي | InChI=1S/CH2O3.Ni/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
خصائص كربونات النيكل
صيغة كربونات النيكل
الصيغة الكيميائية لأحادي كربونات النيكل هي NiCO3. وتتكون من ذرة نيكل واحدة (Ni)، وذرة كربون واحدة (C) وثلاث ذرات أكسجين (O).
كربونات النيكل الكتلة المولية
تبلغ الكتلة المولية لأحادي كربونات النيكل (NiCO3) حوالي 118.7 جرامًا لكل مول. يتم الحصول على هذه القيمة من خلال جمع الكتل الذرية للعناصر المكونة لها.
نقطة غليان كربونات النيكل
ليس لدى أحادي كربونات النيكل نقطة غليان مميزة لأنها تميل إلى التحلل قبل الوصول إلى نقطة الغليان. عند تسخينه، فإنه يتحلل إلى أكسيد النيكل وثاني أكسيد الكربون والأكسجين.
نقطة انصهار كربونات النيكل
لدى أحادي كربونات النيكل نقطة انصهار تبلغ حوالي 200 درجة مئوية (392 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول من الحالة الصلبة إلى الحالة السائلة.
كثافة كربونات النيكل جم/مل
تبلغ كثافة أحادي كربونات النيكل حوالي 3.6 جرام لكل سنتيمتر مكعب (جم / سم مكعب). تشير قيمة الكثافة هذه إلى كتلة المركب لكل وحدة حجم.
الوزن الجزيئي لكربونات النيكل
يبلغ الوزن الجزيئي لأحادي كربونات النيكل (NiCO3) حوالي 118.7 جرامًا لكل مول. ويتم حسابه عن طريق إضافة الأوزان الذرية للذرات المكونة له.
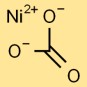
هيكل كربونات النيكل
يحتوي أحادي كربونات النيكل على بنية أساسية ترتبط فيها ذرة النيكل المركزية بثلاث ذرات أكسجين في ترتيب مثلث. وهذا يشكل جوهر أيون الكربونات. يتم تثبيت الهيكل معًا بواسطة روابط أيونية وتساهمية.
ذوبان كربونات النيكل
أحادي كربونات النيكل ضعيف الذوبان في الماء. تزداد قابليته للذوبان مع انخفاض الرقم الهيدروجيني للمحلول. ويمكن أن يذوب أيضًا في المحاليل الحمضية التي تحتوي على مواد مثل حمض الهيدروكلوريك.
خصائص أحادي كربونات النيكل تجعلها مفيدة في مجموعة متنوعة من التطبيقات. عدم قابليته للذوبان في الماء يجعله مناسبًا للتطبيقات في السيراميك والأصباغ. يساهم تحلله عند درجات حرارة عالية في استخدامه في العمليات التحفيزية.
| مظهر | أخضر سادة |
| جاذبية معينة | 3.6 جم/سم3 |
| لون | أخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | 118.7 جرام/مول |
| كثافة | 3.6 جم/سم3 |
| نقطة الانصهار | 200 درجة مئوية (392 درجة فهرنهايت) |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | ضعيف الذوبان |
| الذوبان | قابل للذوبان في الأحماض مثل حمض الهيدروكلوريك |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر كربونات النيكل
يشكل أحادي كربونات النيكل مخاطر محتملة على السلامة. قد يؤدي إلى تهيج الجلد والعينين عند ملامسته، مما يسبب الاحمرار وعدم الراحة. استنشاق غباره أو أبخرةه قد يسبب تهيج الجهاز التنفسي أو السعال. ويُنصح بالتعامل معه بحذر، وارتداء معدات الحماية المناسبة مثل القفازات والنظارات. تجنب تناول أو استنشاق المركب. إذا تعرضت للمرض، اغسل المناطق المصابة واطلب الرعاية الطبية إذا استمرت الأعراض. تعتبر تدابير التهوية والاحتواء الكافية ضرورية لتقليل المخاطر. يعد اتباع بروتوكولات السلامة عند العمل باستخدام أحادي كربونات النيكل أمرًا بالغ الأهمية لمنع المشكلات الصحية المحتملة وضمان بيئة آمنة.
| رموز الخطر | مهيجة، خطر على الصحة |
| وصف الأمان | مهيج. تجنب الاتصال والاستنشاق. التعامل مع الرعاية |
| أرقام تعريف الأمم المتحدة | لا ينسب |
| رمز النظام المنسق | 2836.40.00 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير مصنف |
| تسمم | قد يسبب تهيج الجلد والعين؛ تهيج الجهاز التنفسي في حالة استنشاقه |
طرق تصنيع كربونات النيكل
يمكن تصنيع أحادي كربونات النيكل بطرق مختلفة. يتضمن النهج الشائع التفاعل بين ملح النيكل القابل للذوبان (مثل كلوريد النيكل أو كبريتات النيكل ) وملح الكربونات القابلة للذوبان (مثل كربونات الصوديوم) في الماء. ويتم خلط المحلولين مما يؤدي إلى تكوين أحادي كربونات النيكل غير القابلة للذوبان على شكل راسب أخضر. يتم بعد ذلك ترشيح هذا الراسب وغسله وتجفيفه للحصول على المنتج النهائي.
تتضمن الطريقة الأخرى التفاعل بين أكسيد النيكل أو هيدروكسيد النيكل وغاز ثاني أكسيد الكربون في وجود الرطوبة. وينتج عن ذلك تكوين أحادي كربونات النيكل مع الماء. غالبًا ما تستخدم هذه العملية صناعيًا لإنتاج أحادي كربونات النيكل.
بالإضافة إلى ذلك، يمكن استخدام عملية الترسيب عن طريق خلط محلول من ملح النيكل القابل للذوبان مع محلول ملح كربونات قابل للذوبان. يتم تقليب الخليط الناتج ثم يتم تجميع راسب أحادي كربونات النيكل المتكون ومعالجته.
تنتج طرق التوليف هذه أحادي كربونات النيكل لتطبيقات مختلفة مثل السيراميك والمحفزات والأصباغ. يعد التحكم الدقيق في ظروف التفاعل وخطوات التنقية أمرًا بالغ الأهمية للحصول على منتجات أحادية كربونات النيكل عالية الجودة.
استخدامات كربونات النيكل
تجد أحاديات كربونات النيكل تطبيقات مختلفة نظرًا لخصائصها الفريدة. بعض الاستخدامات الهامة تشمل:
- إنتاج السيراميك والزجاج: تعمل أحاديات كربونات النيكل على تعزيز السيراميك والزجاج بألوان نابضة بالحياة للتعبير الفني والاستخدام الصناعي.
- المحفز: يعمل كمحفز أو مقدمة محفزة في العمليات الكيميائية المختلفة، حيث يسهل تفاعلات الأكسدة من خلال إطلاق الأكسجين أثناء التحلل عند درجات حرارة عالية.
- الطلاء الكهربائي: استخدام أحادي كربونات النيكل كمقدمة يسمح بالطلاء الكهربائي للنيكل على الأسطح المختلفة، وبالتالي تعزيز مظهر السطح ومقاومة التآكل.
- صناعة البطاريات: في تقنيات البطاريات، وخاصة تلك التي تعتمد على النيكل، فإنه يساهم في المواد الكاثودية، مما يدعم تقدم أنظمة البطاريات.
- الأصباغ والأحبار: يعتبر أحادي كربونات النيكل جزءًا لا يتجزأ من إنتاج مجموعة من الأشكال الخضراء في الأصباغ والأحبار والدهانات.
- الزراعة: استخدامه كمصدر للنيكل المغذي في الأسمدة يفيد نمو النبات ويستخدم في الزراعة.
- الطب: على الرغم من ندرته، إلا أن الباحثين يستكشفون التطبيقات الطبية المحتملة بسبب بعض مركبات النيكل، ولا سيما أحادي كربونات النيكل، مما يدل على خصائص مضادة للميكروبات.
- التصوير الفوتوغرافي: تاريخياً، وجد دوراً في أحبار التصوير الفوتوغرافي بالأبيض والأسود، حيث يعمل على إثراء الظلال والتباينات.
- المنسوجات: تستخدم صناعة النسيج أحادي كربونات النيكل لتحسين امتصاص الأصباغ وإضفاء اللون على الأقمشة.
- البحث والتعليم: تثبت الخصائص الكيميائية لأحادي كربونات النيكل أهميته في مختبرات الكيمياء للعروض التعليمية والتجارب والأبحاث.
توضح هذه التطبيقات المتنوعة أهمية أحادي كربونات النيكل في مختلف الصناعات، بدءًا من تحسين جماليات السيراميك وحتى لعب دور في التقنيات المتقدمة مثل البطاريات والمحفزات.
أسئلة:
س: ما هو العنصر الأكثر تفاعلاً؟
ج: الصوديوم.
س: ما هي المادة المفيدة التي تنتج من خلط الحديد مع الكروم والكربون والنيكل؟
ج: الفولاذ المقاوم للصدأ.
س: هل كربونات النيكل قابلة للذوبان في الماء؟
ج: غير قابل للذوبان للغاية.
س: ما عدد مولات الكربون الموجودة في رباعي كربونيل النيكل؟
ج: أربعة شامات.
س: كيفية إزالة طلاء النيكل من الفولاذ الكربوني؟
ج: استخدام عوامل التجريد الكيميائية المناسبة أو الطرق الكهروكيميائية.
س: المعادلة الأيونية الصافية لنترات النيكل (II) وكربونات الصوديوم؟
أ: Ni²⁺ + CO₃²⁻ → NiCO₃(s).
س: دور أول أكسيد الكربون في استخراج النيكل؟
ج: يعمل كعامل اختزال لاستخراج النيكل من خاماته.
س: ذوبان كربونات النيكل؟
ج: قليل الذوبان في الماء.
س: الأعداد الذرية للكربون والصوديوم والنيكل؟
ج: الكربون: 6، الصوديوم: 11، النيكل: 28.
س: ماذا يحدث عند خلط كربونات الأمونيوم وكلوريد النيكل والماء؟
ج: تكوين راسب أحادي كربونات النيكل وإطلاق غاز كلوريد الأمونيوم.
