كربونات الكالسيوم مركب كيميائي له الصيغة CaCO3. ويوجد عادة في الصخور والأصداف ويستخدم في إنتاج الأسمنت والدهانات والمكملات الغذائية.
| اسم الأيوباك | كربونات الكالسيوم |
| الصيغة الجزيئية | كربونات الكالسيوم 3 |
| CAS رقم | 471-34-1 |
| المرادفات | الحجر الجيري، الطباشير، الكالسيت، الأراغونيت، الرخام، كربونات الكالسيوم المترسبة، ملح الكالسيوم لحمض الكربونيك (1:1) |
| إنتشي | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
CaCO3 الكتلة المولية
الكتلة المولية لكربونات الكالسيوم هي 100.09 جم/مول. وهذا يعني أن مول واحد من كربونات الكالسيوم يحتوي على 100.09 جرام من المركب. تعتبر الكتلة المولية مهمة في الحسابات المتكافئة لأنها تسمح بالتحويل من المولات إلى الجرام أو العكس.
صيغة كربونات الكالسيوم
الصيغة الكيميائية لكربونات الكالسيوم هي CaCO₃. وهذا يعني أن كل جزيء من كربونات الكالسيوم يحتوي على ذرة كالسيوم واحدة، وذرة كربون واحدة، وثلاث ذرات أكسجين. الصيغة مهمة لتحديد كمية كربونات الكالسيوم اللازمة لتطبيق معين وفهم خصائصه الكيميائية.
نقطة غليان كربونات الكالسيوم
ليس لكربونات الكالسيوم درجة غليان لأنها تتحلل قبل أن تصل إلى درجة الغليان. عند الضغط الجوي، تتحلل كربونات الكالسيوم إلى أكسيد الكالسيوم وثاني أكسيد الكربون عند درجات حرارة أعلى من 825 درجة مئوية. لذلك، يتم استخدام كربونات الكالسيوم بشكل شائع في تطبيقات درجات الحرارة المرتفعة، مثل إنتاج الأسمنت.
نقطة انصهار كربونات الكالسيوم
نقطة انصهار كربونات الكالسيوم هي 1339 درجة مئوية. عند درجة الحرارة هذه، تخضع كربونات الكالسيوم للتحلل الحراري لتكوين أكسيد الكالسيوم وثاني أكسيد الكربون. تعتبر نقطة الانصهار مهمة لفهم سلوك كربونات الكالسيوم عند درجات الحرارة المرتفعة.
كثافة كربونات الكالسيوم جم/مل
تبلغ كثافة كربونات الكالسيوم 2.71 جم/سم3. وهذا يعني أن كربونات الكالسيوم أكثر كثافة من الماء وسوف تغوص عند وضعها في الماء. تعتبر الكثافة مهمة لفهم الخواص الفيزيائية لكربونات الكالسيوم ولتحديد استخداماتها في التطبيقات المختلفة.
الوزن الجزيئي لكربونات الكالسيوم
الوزن الجزيئي لكربونات الكالسيوم هو 100.09 جم / مول. وهذا يعني أن المركب يتكون من ذرة كالسيوم واحدة، وذرة كربون واحدة، وثلاث ذرات أكسجين. الوزن الجزيئي مهم لتحديد كمية كربونات الكالسيوم اللازمة لتطبيق معين وفهم خصائصه الكيميائية.
هيكل كربونات الكالسيوم
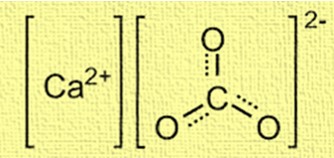
هيكل كربونات الكالسيوم بلوري ويتكون من أيونات الكالسيوم (Ca²⁺) وأيونات الكربونات (CO₃²⁻). وتقع أيونات الكالسيوم في وسط الهيكل وتحيط بها ستة أيونات كربونات. يتم ترتيب أيونات الكربونات في شكل مستو مثلثي، حيث ترتبط كل ذرة أكسجين بذرة الكربون بواسطة رابطة مزدوجة. يعد الهيكل مهمًا لفهم سلوك كربونات الكالسيوم في التطبيقات المختلفة، مثل تكوين الأصداف والشعاب المرجانية.
| مظهر | مسحوق أبيض أو كريستال عديم اللون |
| جاذبية معينة | 2.71 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 100.09 جرام/مول |
| كثافة | 2.71 جم/سم3 |
| نقطة الانصهار | 1339 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 0.0013 جم/100 مل (25 درجة مئوية) |
| الذوبان | غير قابل للذوبان في الماء ومعظم المذيبات العضوية |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 9:00 صباحًا (الأولى)؛ 11.8 (ثانية) |
| الرقم الهيدروجيني | 9.3 – 9.7 (0.1 م محلول مائي) |
سلامة ومخاطر كربونات الكالسيوم
تعتبر كربونات الكالسيوم آمنة بشكل عام للإنسان والبيئة عند استخدامها وفقًا للتعليمات. ومع ذلك، فإن استنشاق غبار كربونات الكالسيوم قد يسبب تهيج الجهاز التنفسي والعينين والجلد. التعرض طويل الأمد لتركيزات عالية من غبار كربونات الكالسيوم يمكن أن يسبب تلف الرئة. يمكن أن تتفاعل كربونات الكالسيوم أيضًا مع الأحماض القوية لإنتاج ثاني أكسيد الكربون، مما قد يتسبب في نشوب حريق أو خطر الانفجار في مواقف معينة. ومن المهم اتباع إجراءات السلامة المناسبة عند التعامل مع كربونات الكالسيوم، مثل ارتداء معدات الحماية وضمان التهوية الكافية.
| رموز الخطر | غير قابل للتطبيق |
| وصف الأمان | تجنب استنشاق الغبار. ارتداء معدات الحماية. |
| أرقام تعريف الأمم المتحدة | غير منتظم |
| رمز النظام المنسق | 2836.50.00 |
| فئة الخطر | غير منتظم |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة للإنسان والبيئة |
طرق تصنيع كربونات الكالسيوم
يمكن لطرق مختلفة تصنيع كربونات الكالسيوم (CaCo3)، بما في ذلك طرق الترسيب والكربنة وطرق السول.
تتضمن طريقة الترسيب خلط هيدروكسيد الكالسيوم مع ملح كربونات قابل للذوبان، مثل كربونات الصوديوم ، تحت ظروف محكومة لتكوين راسب CaCo3. للحصول على المنتج النهائي، يجب تصفية الراسب وتجفيفه.
تتضمن طريقة الكربنة تفاعل أكسيد الكالسيوم مع ثاني أكسيد الكربون تحت ضغط ودرجة حرارة مرتفعين لإنتاج CaCo3. يجب أن يتم التفاعل في نظام مغلق لمنع هروب ثاني أكسيد الكربون. بعد ذلك، يجب فصل أي أكسيد الكالسيوم أو ثاني أكسيد الكربون غير المتفاعل عن CaCo3 الناتج وتنقيته.
تتضمن طريقة السول جل التحلل المائي وتكثيف المادة الأولية المحتوية على الكالسيوم، مثل ألكوكسيد الكالسيوم أو نترات الكالسيوم، في وجود مذيب ومحفز. لإنتاج CaCo3، يجب تجفيف الهلام الناتج وتكلسه.
تتضمن طريقة تصنيع CaCo3 استخدام التمعدن الحيوي، حيث تقوم الكائنات الحية مثل المرجان أو أصداف المحار بتوليد بلورات CaCo3. يقوم المشغلون بجمع هذه البلورات ومعالجتها للحصول على المنتج النهائي.
كل طريقة لها مزاياها وعيوبها، ويعتمد اختيار الطريقة على عوامل مثل التكلفة والنقاء وحجم الجسيمات المطلوبة للمنتج النهائي.
استخدامات كربونات الكالسيوم
لكربونات الكالسيوم العديد من الاستخدامات في مختلف الصناعات، وذلك بسبب خصائصها مثل انخفاض السمية، والنقاء العالي، وتوافرها منخفض التكلفة. بعض الاستخدامات الشائعة لكربونات الكالسيوم هي:
- البناء: يستخدم كمادة بناء على شكل الحجر الجيري والرخام والطباشير. يستخدم كمادة حشو لتحسين قوة ومتانة الأسمنت والملاط والخرسانة.
- المستحضرات الصيدلانية: تستخدم في إنتاج مضادات الحموضة ومكملات الكالسيوم. يستخدم كسواغ في تركيب الأقراص والكبسولات.
- الأغذية والمشروبات: يستخدم كمادة مضافة للأغذية لتعزيز الكالسيوم وكمنظم لدرجة الحموضة في المشروبات.
- الورق واللب: يستخدم كمادة حشو وطلاء في إنتاج الورق والكرتون، لتحسين قابلية الطباعة والبياض.
- البلاستيك: يستخدم كمادة حشو وتقوية في المنتجات البلاستيكية لتحسين خواصها الميكانيكية وخفض التكاليف.
- الدهانات والطلاءات: تستخدم كصبغة وحشو في الدهانات والطلاءات لتحسين العتامة والتغطية.
- الزراعة: يستخدم كمحسن للتربة لتحسين نوعية التربة ونمو المحاصيل.
- معالجة المياه: يستخدم لتحييد المياه الحمضية وإزالة الشوائب من المياه.
هذه بعض الاستخدامات الأكثر شيوعًا لكربونات الكالسيوم، ولكن هناك العديد من التطبيقات الأخرى في مختلف الصناعات.
أسئلة:
س: هل كربونات الكالسيوم تذوب في الماء؟
ج: كربونات الكالسيوم منخفضة الذوبان في الماء، حيث تبلغ قابلية الذوبان حوالي 0.0013 جم/100 مل عند 25 درجة مئوية.
س: ما هي كربونات الكالسيوم؟
ج: كربونات الكالسيوم مركب كيميائي له الصيغة CaCO3. وهي مادة شائعة توجد في الصخور وأصداف الكائنات البحرية وفي الرواسب المعدنية المختلفة.
س: أين يمكن العثور على كربونات الكالسيوم؟
ج: يمكن العثور على كربونات الكالسيوم في مصادر طبيعية مختلفة مثل الحجر الجيري والطباشير والرخام. ويوجد أيضًا في أصداف الكائنات البحرية مثل المحار والمحار والشعاب المرجانية.
س: هل كربونات الكالسيوم أيونية أم تساهمية؟
ج: كربونات الكالسيوم مركب أيوني يتكون من كاتيون الكالسيوم (Ca2+) وأنيون الكربونات (CO32-).
س: كربونات الكالسيوم هي نوع من الرواسب المهدرجة التي يمكن دفنها وتصلبها إلى _____.
ج: كربونات الكالسيوم هي نوع من الرواسب المهدرجة التي يمكن دفنها وتصلبها في الحجر الجيري.
س: تسمى الهياكل الطبقية المكونة من كربونات الكالسيوم بواسطة البكتيريا الزرقاء في عصر ما قبل الكمبري بـ _____.
ج: تسمى الهياكل الطبقية المصنوعة من كربونات الكالسيوم بواسطة البكتيريا الزرقاء في عصر ما قبل الكمبري بالستروماتوليت.
