كربونات الصوديوم أو كربونات الصوديوم مركب غير عضوي له الصيغة الكيميائية Na2CO3. وهو ملح قلوي أبيض اللون وقابل للذوبان في الماء. يتم استخدامه في العديد من العمليات الصناعية والتجارية، مثل صناعة الزجاج والورق والصابون والمنظفات ومنتجات التنظيف.
| اسم الأيوباك | كربونات الصوديوم |
| الصيغة الجزيئية | Na2CO3 |
| CAS رقم | 497-19-8 |
| المرادفات | Na2CO3 اللامائي، Na2CO3 منزوع الماء، صودا الغسيل، كربونات الصوديوم |
| إنتشي | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
خصائص كربونات الصوديوم
كربونات الصوديوم الكتلة المولية
الكتلة المولية لكربونات الصوديوم هي 106.0 جم/مول. وهو مجموع الكتل الذرية لجميع الذرات الموجودة في جزيء كربونات الصوديوم. الكتلة المولية هي خاصية فيزيائية مهمة تستخدم في العديد من العمليات الحسابية في الكيمياء والعلوم الأخرى.
نقطة غليان كربونات الصوديوم
درجة غليان كربونات الصوديوم هي 1600 درجة مئوية. هذه هي درجة الحرارة التي يساوي فيها ضغط بخار السائل ضغط الجو المحيط ويغلي السائل. تعتبر نقطة الغليان خاصية مفيدة لتحديد وفصل المركبات المختلفة.
نقطة انصهار كربونات الصوديوم
Na2CO3 لديه نقطة انصهار تبلغ 851 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها الشكل الصلب للمركب إلى سائل. تعتبر نقطة الانصهار خاصية مهمة تستخدم في تحديد وتنقية المواد المختلفة.
كثافة كربونات الصوديوم جم/مل
تبلغ كثافة Na2CO3 2.54 جم / مل. يتم تعريف الكثافة على أنها الكتلة لكل وحدة حجم من المادة وهي خاصية مفيدة لتحديد تركيز المحلول.
الوزن الجزيئي لكربونات الصوديوم
الوزن الجزيئي لكربونات الصوديوم هو 106 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. يعد الوزن الجزيئي خاصية مهمة تستخدم في العديد من العمليات الحسابية في الكيمياء والعلوم الأخرى.
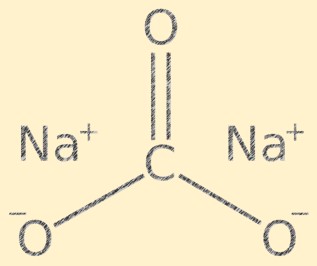
هيكل كربونات الصوديوم
يحتوي Na2CO3 على بنية بلورية ويتكون من كاتيونات الصوديوم (Na+) وأنيونات الكربونات (CO3-). أيون الكربونات له شكل مستو مثلثي، حيث توجد ذرة الكربون في المركز وذرات الأكسجين متصلة به بزاوية 120 درجة. ترتبط أيونات الصوديوم وأيونات الكربونات معًا بواسطة روابط أيونية، مما يعطي المركب تركيبه البلوري المميز.
| مظهر | مسحوق بلوري أبيض أو بلورات بيضاء صغيرة |
| جاذبية معينة | 2.54 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 106.0 جرام/مول |
| كثافة | 2.54 جم/مل |
| نقطة الانصهار | 851 درجة مئوية |
| نقطة الغليان | 1600 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يذوب في الماء |
| الذوبان | قابل للذوبان في الجلسرين، قابل للذوبان بشكل طفيف في الإيثانول |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | 10.3 |
| الرقم الهيدروجيني | 11.6 (حل 1M) |
سلامة ومخاطر كربونات الصوديوم
كربونات الصوديوم مركب أساسي ويمكن أن يسبب تهيج الجلد والعين. استنشاق غبارها قد يسبب تهيج الجهاز التنفسي. كما أنه ضار إذا تم ابتلاعه ويمكن أن يسبب اضطرابًا في الجهاز الهضمي. يجب أن تتم المعالجة بالقفازات والنظارات الواقية، ويجب تخزين المادة في مكان بارد وجاف بعيدًا عن مصادر الاشتعال. تجنب تناول أو استنشاق المسحوق واغسله جيدًا بعد التعامل معه.
| رموز الخطر | الحادي عشر، ن |
| وصف الأمان | مهيج |
| أرقام تعريف الأمم المتحدة | أ 1824 |
| رمز النظام المنسق | 2836.90.90 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 عن طريق الفم (الجرذ) = 915 ملغم/كغم. استنشاق LC50 (الجرذ) => 10 ملغم/لتر/4 ساعات. قد يسبب تهيج الجلد والعين، وتهيج الجهاز التنفسي في حالة استنشاقه. قد تكون ضارة إذا ما ابتلع. |
طرق تصنيع كربونات الصوديوم
يمكن تصنيع كربونات الصوديوم بطريقتين رئيسيتين: عملية سولفاي وطريقة الترسيب. تتضمن عملية سولفاي، المعروفة أيضًا باسم عملية صودا الأمونيا، تفاعل كلوريد الصوديوم والأمونيا وثاني أكسيد الكربون لإنتاج كربونات الصوديوم وكلوريد الأمونيوم والماء. تتضمن طريقة الترسيب تفاعل هيدروكسيد الصوديوم وثاني أكسيد الكربون لإنتاج كربونات الصوديوم والماء. تؤدي كلتا الطريقتين إلى منتج عالي النقاء يمكن استخدامه في تطبيقات مختلفة مثل معالجة المياه وتصنيع الصابون والمنظفات وإنتاج الزجاج. تعد عملية سولفاي هي الطريقة الأكثر استخدامًا نظرًا لانخفاض تكلفة إنتاجها وارتفاع إنتاجها.
استخدامات كربونات الصوديوم
تستخدم الصناعات كربونات الصوديوم أو صودا الغسيل لأغراض مختلفة. تستخدمه صناعة المنظفات كمنقي للمياه وضابط درجة الحموضة، وتستخدمه صناعة الزجاج لإنشاء زجاج مسطح وزجاج التعبئة والتغليف والزجاج المتخصص، وتستخدمه صناعة الورق لتحييد تيارات النفايات الحمضية وضبط درجة الحموضة. في الصناعة الكيميائية، تعد كربونات الصوديوم مكونًا رئيسيًا في إنتاج سيليكات الصوديوم وبيكربونات. كما أنه بمثابة المضافات الغذائية وعامل التنظيف في الغلايات وعمليات معالجة المياه في صناعة المواد الغذائية. بالإضافة إلى ذلك، تلعب كربونات الصوديوم دورًا في إنتاج الأصباغ والمينا والسيراميك وتعمل كمطفأة للحريق في طفايات الحريق.
