كربونات الأمونيوم ((NH4)2CO3) عبارة عن ملح. ويتكون عندما تتفاعل الأمونيا وثاني أكسيد الكربون. وله استخدامات عديدة، مثل الخبز ورائحة الملح.
| اسم الأيوباك | كربونات الأمونيوم |
| الصيغة الجزيئية | (NH4) 2CO3 |
| CAS رقم | 506-87-6 |
| المرادفات | أمونيا الخباز، الملح المتطاير، ملح هارتشورن، E503 |
| إنتشي | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
خصائص كربونات الأمونيوم
صيغة كربونات الأمونيوم
الصيغة الكيميائية أو الصيغة الجزيئية لكربونات الأمونيوم هي (NH4)2CO3 1 . وهو ملح يتكون من أيونين أمونيوم وأيون كربونات واحد. ويمكن كتابته NH4+ + NH4+ + CO3 2- لتوضيح شحنات الأيونات.
كربونات الأمونيوم الكتلة المولية
الكتلة المولية لـ (NH4)2CO3 هي 96.09 جم/مول 2 . لحساب الكتلة المولية، علينا جمع الكتل الذرية لجميع الذرات في الصيغة. الكتل الذرية هي :
- النيتروجين: 14.01 جم/مول
- الهيدروجين: 1.01 جم/مول
- الكربون: 12.01 جم/مول
- الأكسجين: 16.00 جم/مول
وبالتالي، فإن الكتلة المولية لكربونات الأمونيوم هي:
(2 × 14.01) + (8 × 1.01) + 12.01 + (3 × 16.00) = 96.09 جم/مول
درجة غليان كربونات الأمونيوم
(NH4)2CO3 ليس له نقطة غليان لأنه يتحلل قبل الوصول إلى درجة الحرارة هذه. عند تسخينه، فإنه يتحلل إلى الأمونيا وثاني أكسيد الكربون، الذي يتسرب من المادة الصلبة. رد فعل التحلل هو:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
وتعتمد درجة حرارة التحلل على رطوبة وضغط البيئة، ولكنها تبلغ بشكل عام حوالي 60 درجة مئوية.
نقطة انصهار كربونات الأمونيوم
(NH4)2CO3 لديه نقطة انصهار تبلغ 58 درجة مئوية (136 درجة فهرنهايت؛ 331 كلفن). ومع ذلك، فإنه يتحلل أيضًا عند درجة الحرارة هذه، وبالتالي لا يشكل مرحلة سائلة. وبدلا من ذلك، فإنه يتصاعد مباشرة من الحالة الصلبة إلى الحالة الغازية.
كثافة كربونات الأمونيوم جم/مل
كثافة (NH4)2CO3 هي 1.50 جم/مل. الكثافة هي الكتلة لكل وحدة حجم المادة. لحساب الكثافة، قم بتقسيم الكتلة على الحجم. على سبيل المثال، إذا كان لدينا 10 جم من (NH4)2CO3 وتشغل مساحة 6.67 مل، فإن الكثافة هي:
10 جم / 6.67 مل = 1.50 جم / مل
الوزن الجزيئي لكربونات الأمونيوم
الوزن الجزيئي لـ (NH4)2CO3 هو نفس كتلته المولية، وهي 96.09 جم/مول. غالبًا ما يتم استخدام الوزن الجزيئي والكتلة المولية بالتبادل، لكن لهما معاني مختلفة قليلاً. الوزن الجزيئي هو كتلة جزيء واحد من المادة، في حين أن الكتلة المولية هي كتلة مول واحد (6.022 × 10 ^ 23 جزيء) من المادة.
هيكل كربونات الأمونيوم
يمكن تمثيل بنية (NH4)2CO3 ببنية نقطة لويس أو نموذج الكرة والعصا. يُظهر هيكل نقطة لويس إلكترونات التكافؤ لكل ذرة وكيفية مشاركتها أو نقلها لتكوين روابط. يوضح نموذج الكرة والعصا شكل الذرات والروابط وترتيبها في ثلاثة أبعاد.
فيما يلي بنية نقطة لويس المحتملة لكربونات الأمونيوم:
اووو
|| || ||
HNH HNH HCH
| | |
سموه
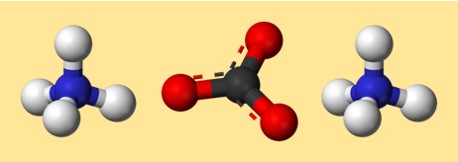
فيما يلي نموذج محتمل لكربونات الأمونيوم:
في هذا النموذج، يمثل كل لون عنصرًا مختلفًا:
- الرمادي: الكربون
- الأحمر: الأكسجين
- الأزرق: النيتروجين
- الأبيض: الهيدروجين
ذوبان كربونات الأمونيوم
(NH4) 2CO3 قابل للذوبان في الماء. الذوبان هو قدرة المادة على الذوبان في مادة أخرى. عندما يذوب (NH4)2CO3 في الماء، فإنه يشكل أيونات مائية يمكنها التفاعل مع أيونات أو جزيئات أخرى في المحلول. رد فعل الذوبان هو:
(NH4) 2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
تعتمد ذوبان (NH4)2CO3 على درجة الحرارة ودرجة الحموضة في الماء. عند درجات الحرارة المرتفعة، يمكن أن يذوب المزيد من (NH4)2CO3 في الماء.
| مظهر | بودرة بيضاء |
| كثافة محددة | 1.50 |
| لون | عديم اللون |
| يشم | رائحة الأمونيا النفاذة |
| الكتلة المولية | 96.09 جرام/مول |
| كثافة | 1.50 جرام/مل |
| نقطة الانصهار | 58 درجة مئوية (136 درجة فهرنهايت; 331 ألف) |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 100 جم/100 مل (15 درجة مئوية) |
| الذوبان | قابل للذوبان في الماء والكحول والأسيتون |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | 9.25 (لـ NH4+) |
| الرقم الهيدروجيني | 7.8 (لمحلول 0.1 م) |
السلامة ومخاطر كربونات الأمونيوم
(NH4)2CO3 هي مادة خطرة يمكن أن تسبب تهيجًا وتلفًا للجلد والعينين والأنف والحنجرة والرئتين. وقد يكون ضارًا أيضًا إذا تم ابتلاعه. وينبغي التعامل معه بعناية وباستخدام معدات الحماية الشخصية، مثل القفازات والنظارات الواقية والأقنعة. يجب أن يتم تخزينه في مكان بارد وجاف وجيد التهوية، بعيدا عن الحرارة والشرر واللهب. ولا ينبغي خلطه مع الأحماض القوية أو القواعد أو عوامل الاختزال، لأنها قد تتفاعل بعنف أو تطلق غازات سامة. إذا تعرضت، اطلب العناية الطبية على الفور.
| رموز الخطر | شي (مزعج) |
| وصف الأمان | S22: لا تتنفس الغبار. S24/25: تجنب ملامسة الجلد والعينين. |
| أرقام تعريف الأمم المتحدة | UN3077 |
| رمز النظام المنسق | 28369910 |
| فئة الخطر | 9 |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرذ LD50 عن طريق الفم: 2000 ملغم/كغم |
طرق تصنيع كربونات الأمونيوم
يمكن لطرق مختلفة تصنيع (NH4)2CO3، اعتمادًا على المواد التي تبدأ بها والنقاء المطلوب للمنتج. فيما يلي بعض الأمثلة على طرق تصنيع (NH4)2CO3:
- تتضمن إحدى الطرق تفاعل كبريتات الأمونيوم مع كلوريد الأمونيوم وكربونات الكالسيوم في الفرن. ينتج عن التفاعل (NH4)2CO3 وكلوريد الكالسيوم كمنتجات ثانوية. رد الفعل هو:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- تتضمن الطريقة الأخرى التفاعل مع ثاني أكسيد الكربون والأمونيا في محلول مائي. ينتج عن التفاعل (NH4)2CO3 وماء كمنتجات ثانوية. رد الفعل هو:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- الطريقة الثالثة تتضمن تعريض محلول الأمونيوم للهواء المحتوي على ثاني أكسيد الكربون. بيكربونات الأمونيوم هي نتاج التفاعل ويمكن أن يؤدي التسخين إلى تفتيتها إلى (NH4)2CO3.
ردود الفعل هي:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- إن تعرض بيكربونات الأمونيوم للهواء ينتج (NH4)2CO3 للاستخدام التجاري. تتحلل بيكربونات الأمونيوم إلى أمونيا وثاني أكسيد الكربون، اللذين يتفاعلان مرة أخرى لتكوين (NH4)2CO3. العملية هي:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
استخدامات كربونات الأمونيوم
(NH4)2CO3 له استخدامات متعددة في مجالات مختلفة، مثل:
- يستخدمه الخبازون كعامل ترك، خاصة للبسكويت والمقرمشات المسطحة أو المقرمشة. وينتج ثاني أكسيد الكربون وغازات الأمونيا التي تساعد العجين على الارتفاع وخلق قوام خفيف. كما أنه يعزز نكهة ورائحة المخبوزات.
- يستخدمه الناس كملح ذو رائحة لإحياء الأشخاص الذين فقدوا وعيهم أو يشعرون بالتعاسة. يحفز الجهاز التنفسي ويرفع ضغط الدم عن طريق إطلاق أبخرة الأمونيا التي تهيج الأنف والرئتين.
- بعض شراب السعال وطاردات البلغم، مثل شراب السعال من باكلي، يستخدمه كمكون نشط. يساعد على تفكيك وطرد البلغم من الصدر والحلق عن طريق زيادة إفراز المخاط.
- يستخدمه الأطباء كمقيئ للحث على القيء في حالات التسمم أو الجرعة الزائدة. فهو يهيج بطانة المعدة ويسبب الغثيان والقيء عن طريق إطلاق ثاني أكسيد الكربون.
- ويستخدمه الكيميائيون ككاشف في بعض التفاعلات الكيميائية، مثل تخليق اليوريا ونترات الأمونيوم وكبريتات الأمونيوم. كما أنه يعمل كمنطقة عازلة للحفاظ على الرقم الهيدروجيني للحلول.
أسئلة:
س: هل كربونات الأمونيوم حمضية أم قاعدية؟
ج: (NH4)2CO3 هو ملح يمكن أن يتفاعل مع كل من الأحماض والقواعد. وعندما يذوب في الماء، فإنه يشكل أيونات الأمونيوم وأيونات الكربونات. يمكن أن تعمل أيونات الأمونيوم كأحماض ضعيفة وتمنح البروتونات إلى الماء، بينما يمكن لأيونات الكربونات أن تعمل كقواعد ضعيفة وتستقبل البروتونات من الماء. يعتمد الرقم الهيدروجيني للمحلول على القوة النسبية لأيونات الأمونيوم وأيونات الكربونات. إذا كانت أيونات الكربونات قواعد أقوى من أيونات الأمونيوم فهي أحماض، فإن المحلول سيكون قاعديًا. سيكون المحلول حامضيًا إذا كانت أيونات الأمونيوم أحماضًا أقوى من أيونات الكربونات كقواعد. إذا كانت أيونات الأمونيوم وأيونات الكربونات لها نفس القوة، فسيكون المحلول متعادلًا.
س: هل كربونات الأمونيوم ملح؟
ج: نعم، (NH4)2CO3 ملح. الملح هو مركب يتشكل عندما يقوم الحمض والقاعدة بتحييد بعضهما البعض. (NH4)2CO3 يمكن أن يتشكل عندما تتفاعل الأمونيا، وهي قاعدة ضعيفة، مع حمض الكربونيك، وهو حمض ضعيف. رد الفعل هو:
2NH3 + H2CO3 -> (NH4) 2CO3 + H2O
الأمونيا وحمض الكربونيك هما القاعدة الأم وحمض (NH4)2CO3.
س: هل لكربونات الأمونيوم (aq) رائحة في شكل مائي؟
ج: نعم، (NH4)2CO3 (aq) له رائحة في شكل مائي. ترجع الرائحة إلى إطلاق غاز الأمونيا من المحلول. غاز الأمونيا له رائحة نفاذة يمكن أن تهيج الأنف والرئتين. يمكن لغاز الأمونيا أن يتسرب من المحلول لأنه متطاير وذو قابلية منخفضة للذوبان في الماء. تعتمد كمية غاز الأمونيا المنطلقة على درجة حرارة المحلول وتركيزه.
س: ما نوع ذرة كربونات الأمونيوم؟
ج: (NH4)2CO3 ليس ذرة، بل هو جزيء. الجزيء عبارة عن مجموعة من الذرات المرتبطة ببعضها البعض من خلال مشاركة الإلكترونات. الذرة هي أصغر وحدة من المادة ذات هوية كيميائية محددة. (NH4)2CO3 هو جزيء يتكون من أربعة أنواع مختلفة من الذرات: النيتروجين والهيدروجين والكربون والأكسجين. الصيغة الجزيئية لـ (NH4)2CO3 هي (NH4)2CO3.
س: كم عدد الشامات الموجودة في كربونات الأمونيوم؟
ج: للإجابة على هذا السؤال، علينا أن نعرف مقدار (NH4)2CO3 الموجود لدينا من حيث الكتلة أو الحجم. المول هو وحدة قياس تمثل 6.022 × 10^23 جسيمًا من المادة. يمكن حساب عدد مولات المادة عن طريق قسمة كتلتها على كتلتها المولية أو عن طريق ضرب حجمها في مولاريتها. الكتلة المولية لـ (NH4)2CO3 هي 96.09 جم/مول. تعتمد مولارية (NH4)2CO3 على ذوبانه في الماء.
على سبيل المثال، إذا كان لدينا 10 جم من (NH4)2CO3، فيمكننا إيجاد عدد المولات بقسمة 10 جم على 96.09 جم/مول:
10 جم / 96.09 جم / مول = 0.104 مول
إذا كان لدينا 100 مل من محلول 0.1 مولار (NH4) 2CO3، فيمكننا إيجاد عدد المولات بضرب 100 مل في 0.1 مول/لتر:
100 مل × 0.1 مول / لتر = 0.01 مول
س: ما هي الصيغة الكيميائية لكربونات الأمونيوم؟
ج: الصيغة الكيميائية لكربونات الأمونيوم هي (NH4)2CO3. توضح هذه الصيغة أن جزيء (NH4)2CO3 يحتوي على أيوني أمونيوم (NH4+) وأيون كربونات واحد (CO3 2-). تتوازن الشحنات على الأيونات، وبالتالي فإن الشحنة الإجمالية للجزيء تساوي صفرًا.
س: ما عدد مولات أيونات الأمونيوم الموجودة في 6.995 جم من كربونات الأمونيوم؟
ج: للإجابة على هذا السؤال لا بد من اتباع خطوتين:
- أولاً، نحتاج إلى تحديد عدد مولات (NH4)2CO3 الموجودة في 6.995 جم عن طريق قسمة 6.995 جم على كتلته المولية (96.09 جم/مول):
6.995 جم / 96.09 جم / مول = 0.0728 مول
- ثانياً: نحتاج إلى ضرب هذا العدد في اثنين، لأن كل مول من (NH4)2CO3 يحتوي على مولين من أيونات الأمونيوم:
0.0728 مول × 2 = 0.1456 مول
وبالتالي يوجد 0.1456 مول من أيونات الأمونيوم في 6.995 جم من (NH4)2CO3.
س: ما هو الغاز الناتج عن تفاعل حمض الهيدروكلوريك مع كربونات الأمونيوم؟
ج: عندما يتفاعل حمض الهيدروكلوريك مع (NH4)2CO3، فإنهما يخضعان لتفاعل إزاحة مزدوج لإنتاج كلوريد الأمونيوم وحمض الكربونيك. ثم يتحلل حمض الكربونيك إلى الماء وثاني أكسيد الكربون. ثاني أكسيد الكربون هو الغاز الناتج عن هذا التفاعل. المعادلة العامة لهذا التفاعل هي كما يلي:
(NH4)2CO3 + 2 حمض الهيدروكلوريك -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
المعادلة الأيونية الصافية لهذا التفاعل هي:
CO3 2- + 2 H+ -> H2O + CO2
