كبريتات الفضة (Ag2SO4) هي مادة صلبة بيضاء تستخدم في التصوير الفوتوغرافي والكيمياء التحليلية. وهو يذوب في الماء، وعند تسخينه يتحلل إلى أكسيد الفضة وثالث أكسيد الكبريت.
| اسم الأيوباك | كبريتات الفضة |
| الصيغة الجزيئية | Ag2SO4 |
| CAS رقم | 10294-26-5 |
| المرادفات | كبريتات الفضة، كبريتات ديسيلفر، حامض كبريتيك الفضة، أحادي كبريتات ديسيلفر |
| إنتشي | InChI=1S/2Ag.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
خصائص كبريتات الفضة
صيغة كبريتات الفضة
الصيغة الكيميائية لكبريتات الديارجنت هي Ag2SO4. وتتكون من ذرتين من الفضة (Ag) مرتبطة بذرة كبريت واحدة (S) وأربع ذرات أكسجين (O). تمثل الصيغة نسبة الذرات في جزيء الكبريتات المتفاعلة.
كبريتات الفضة الكتلة المولية
يتم حساب الكتلة المولية لكبريتات الديسيلفر عن طريق إضافة الكتل الذرية للعناصر المكونة لها. تمتلك الفضة كتلة ذرية تبلغ 107.87 جرامًا لكل مول (جم/مول)، والكبريت كتلة ذرية 32.07 جم/مول، والأكسجين لديه كتلة ذرية 16.00 جم/مول. وبجمعهما معًا، تبلغ الكتلة المولية للكبريتات المذابة حوالي 311.81 جم/مول.
درجة غليان كبريتات الفضة
ليس لدى كبريتات الديارجنت نقطة غليان مميزة لأنها تتحلل قبل أن تصل إلى نقطة الغليان. عند تسخينه، فإنه يخضع للتحلل الحراري ويتحلل إلى أكسيد الفضة (Ag2O) وثالث أكسيد الكبريت (SO3). ولذلك، فإن نقطة غليان كبريتات الديارجنت غير قابلة للتطبيق.
نقطة انصهار كبريتات الفضة
تبلغ نقطة انصهار كبريتات الديارجنت حوالي 652 درجة مئوية (1206 درجة فهرنهايت). عند درجة الحرارة هذه، تتغير الكبريتات المتفاعلة من الحالة الصلبة إلى الحالة السائلة المنصهرة. من المهم ملاحظة أن نقطة الانصهار قد تختلف قليلاً اعتمادًا على نقاء عينة الكبريتات المتحللة.
كثافة كبريتات الفضة جم/مل
تبلغ كثافة كبريتات الديارجنت حوالي 5.45 جرام لكل مليلتر (جم / مل). تشير هذه القيمة إلى كتلة كبريتات الديارجنت لكل وحدة حجم. تعتمد كثافة المادة بشكل عام على درجة الحرارة، لذلك من المهم مراعاة الظروف عند قياس كثافة الكبريتات المتفاعلة.
الوزن الجزيئي لكبريتات الفضة
يتم حساب الوزن الجزيئي للكبريتات المتفاعلة عن طريق إضافة الأوزان الذرية للعناصر المكونة لها، مع الأخذ في الاعتبار قياس العناصر الكيميائية للصيغة. في حالة كبريتات الديسيلفر (Ag2SO4)، يبلغ الوزن الجزيئي حوالي 311.81 جرام لكل مول (جم/مول).
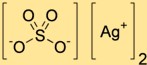
هيكل كبريتات الفضة
تحتوي كبريتات ديسيلفر على بنية بلورية تتكون من كاتيونات الفضة (Ag+) وأنيونات الكبريتات (SO4^2-). الكاتيونات الفضية محاطة بذرات الأكسجين من أنيونات الكبريتات، وتشكل شبكة ثلاثية الأبعاد.
ذوبان كبريتات الفضة
كبريتات الديارجنت ضعيفة الذوبان في الماء. وهو يذوب بدرجة محدودة، حيث يذوب حوالي 0.8 جرام في 100 ملليلتر من الماء في درجة حرارة الغرفة. يمكن أن تتأثر القابلية للذوبان بعوامل مثل درجة الحرارة ووجود المواد المذابة الأخرى في المحلول.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | لا يوجد |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 311.81 جم/مول |
| كثافة | 5.45 جرام/مل |
| نقطة الانصهار | 652 درجة مئوية (1206 درجة فهرنهايت) |
| نقطة الغليان | متحللة |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | ضعيف الذوبان |
| الذوبان | يذوب في عبد القدير. الأحماض والكحول والأسيتون والأثير والأسيتات والأميدات |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | لا يوجد |
السلامة ومخاطر كبريتات الفضة
تشكل كبريتات الديارجنت بعض مخاطر السلامة ويجب توخي الحذر عند التعامل معها. من المهم تجنب استنشاقه أو ابتلاعه أو ملامسته للجلد والعينين. عند التعامل مع كبريتات الديارجنت، فمن المستحسن ارتداء معدات الحماية الشخصية المناسبة، بما في ذلك القفازات والنظارات الواقية ومعطف المختبر. في حالة التعرض العرضي، اشطف المناطق المصابة جيدًا بالماء. قد تسبب كبريتات الديارجنت تهيجًا في الجلد والعين، وقد يؤدي التعرض الطويل أو المتكرر إلى التحسس. ومن الضروري أيضًا التعامل مع كبريتات الديارجنت في منطقة جيدة التهوية لتقليل مخاطر الاستنشاق. يجب اتباع إجراءات التخزين ووضع العلامات والتخلص المناسبة لضمان السلامة.
| رموز الخطر | لا يوجد رمز |
| وصف الأمان | تجنب الاستنشاق والابتلاع وملامسة الجلد والعينين. ارتداء معدات الوقاية الشخصية. التعامل معها في منطقة جيدة التهوية. التخزين السليم ووضع العلامات والتخلص منها. |
| أرقام تعريف الأمم المتحدة | لا يوجد |
| رمز النظام المنسق | 28429090 |
| فئة الخطر | لا يوجد |
| مجموعة التعبئة | لا يوجد |
| تسمم | مهيجة للبشرة والعينين. قد يؤدي التعرض المطول/المتكرر إلى التحسس. |
طرق تصنيع كبريتات الفضة
هناك عدة طرق لتجميع كبريتات الديارجنت.
تتضمن الطريقة الشائعة التفاعل بين نترات الفضة (AgNO3) وحمض الكبريتيك (H2SO4) . في المختبر، أثناء التحريك، يضيف العلماء ببطء نترات الفضة إلى محلول حمض الكبريتيك، مما يؤدي إلى تكوين راسب أبيض يسمى كبريتات ديارجنت. يقومون بجمع الراسب وغسله وتجفيفه للحصول على كبريتات ديارجنت نقية.
كما يحصل العلماء على كبريتات الفضة بإضافة أكسيد الفضة (Ag2O) إلى حامض الكبريتيك وتسخين الخليط أثناء التحريك. تنتج هذه العملية كبريتات متحللة على شكل راسب، والتي يتم ترشيحها وغسلها وتجفيفها للحصول على المنتج النهائي.
بالإضافة إلى ذلك، يمكن للعلماء الحصول على كبريتات الفضة عن طريق تسخين خليط من كلوريد الفضة (AgCl) وحمض الكبريتيك المركز. يضيفون كلوريد الفضة إلى حامض الكبريتيك ويسخنون الخليط. ويؤدي التفاعل إلى تكوين كبريتات الفضة على شكل راسب، والتي يمكن جمعها وغسلها وتجفيفها.
ومن المهم ملاحظة أن أساليب التوليف هذه ينبغي تنفيذها مع احتياطات السلامة المناسبة، بما في ذلك استخدام معدات الحماية المناسبة والعمل في منطقة جيدة التهوية.
استخدامات كبريتات الفضة
لكبريتات ديسيلفر عدة استخدامات في مجالات مختلفة بسبب خصائصها الفريدة. فيما يلي بعض تطبيقاته الشائعة:
- التصوير الفوتوغرافي: في التصوير الفوتوغرافي بالأبيض والأسود، يستخدم المصورون كبريتات ديارجنت كأحد مكونات المستحلبات الحساسة للضوء لالتقاط الصور وتطويرها من خلال التفاعل مع الضوء.
- الكيمياء التحليلية: تستخدم الطرق التحليلية المختلفة كبريتات الفضة ككاشف لاكتشاف وقياس كمية الهاليدات، مثل أيونات الكلوريد والبروميد، من خلال تفاعلات الترسيب.
- الطلاء الكهربائي: تستخدم عمليات الطلاء الكهربائي كبريتات مخففة لترسيب طبقة من الفضة على الأسطح الموصلة، وإنشاء طبقات زخرفية أو واقية على المجوهرات والأجهزة الإلكترونية والأشياء الأخرى.
- عامل مضاد للميكروبات: نظرًا لخصائصه المضادة للميكروبات، فإن كبريتات الديارجنت تستخدم في تركيب الضمادات والمراهم والأجهزة الطبية. فهو يساعد على منع الالتهابات ويعزز الشفاء.
- صناعة البطاريات: تستخدمها صناعة البطاريات كمكون حاسم في مادة الأقطاب الكهربائية لصناعة بطاريات الفضة والزنك والكادميوم الفضية، والتي تنتشر في الأجهزة الإلكترونية والمعدات الطبية.
- الكاشف المعملي: تستخدم كبريتات ديسيلفر ككاشف في مجموعة متنوعة من التجارب المعملية، بما في ذلك تصنيع مركبات الفضة الأخرى وفي تفاعلات الكيمياء العضوية.
- صناعة الزجاج: في صناعة الزجاج، يلعب دورًا حيويًا في إنتاج الزجاج المتخصص، بما في ذلك المرايا الفضية وطلاءات النوافذ الموصلة. يطبق المصنعون طبقة رقيقة من الكبريتات المتحللة لتحقيق هذه الخصائص المطلوبة.
- المحفز: تعمل كبريتات الديسيلفر كمحفز في بعض التفاعلات الكيميائية، بما في ذلك تفاعلات الأكسدة وعمليات البلمرة.
أسئلة:
س: ما الأشياء الأخرى التي تنتج من تفاعل استبدال نترات الفضة وكبريتات البوتاسيوم؟
ج: في تفاعل استبدال AgNO3 وK2SO4، تكون المنتجات المتكونة هي نترات البوتاسيوم (KNO3) وكبريتات ثنائي المادة (Ag2SO4).
س: إذا أضيفت كبريتات الفضة الصلبة إلى المحلول فهل تذوب؟
ج: نعم، سوف تذوب كبريتات ديسيلفر الصلبة الإضافية في المحلول، لأنها ضعيفة الذوبان في الماء.
س: هل يحدث الترسيب عند نترات الفضة + كبريتات الصوديوم؟
ج: نعم، يحدث الترسيب عندما يتفاعل AgNO3 مع كبريتات الصوديوم، مما يؤدي إلى تكوين راسب Ag2SO4 الصلب.
س: ما هي نسبة الفضة في كبريتات الفضة؟
ج: تبلغ نسبة Ag في كبريتات الديارجنت حوالي 63.48%.
س: هل كبريتات الفضة قابلة للذوبان أم غير قابلة للذوبان؟
ج: كبريتات الديارجنت ضعيفة الذوبان في الماء.
س: كيف تجد الصيغة الكيميائية لكبريتات الفضة؟
ج: الصيغة الكيميائية لكبريتات ديسيلفر هي Ag2SO4، والتي يمكن تحديدها على أساس تكافؤ Ag+ الكاتيون وأنيون SO4-2.
س: ما هو لون Ag2SO4؟
ج: كبريتات ديسيلفر (Ag2SO4) مادة صلبة بيضاء اللون.
س: ما هي قيمة Ksp لـ Ag2SO4 إذا كان 5.49 جم قابل للذوبان في 1.00 لتر من الماء؟
ج: يمكن حساب قيمة ثابت منتج الذوبان (Ksp) لـ Ag2SO4 باستخدام المعلومات المقدمة، ولكن هذا يتطلب بيانات إضافية عن تفكك Ag2SO4 في الماء.
س: ما هي الكتلة المولية لـ Ag2SO4؟
ج: تبلغ الكتلة المولية لـ Ag2SO4 حوالي 311.81 جم/مول.
س: هل يتكون Ag2SO4 الصلب عند إذابة 2.7 جم في 100 مل من الماء؟
ج: نعم، قد يتشكل بعض Ag2SO4 الصلب عندما يتجاوز حد ذوبان كبريتات الديارجنت في 100 مل من الماء.
