كبريتيت البوتاسيوم (K2SO3) هو مركب كيميائي يتكون من البوتاسيوم والكبريت والأكسجين. يستخدم عادة كمادة حافظة في صناعة المواد الغذائية لمنع تغير اللون والتلف.
| اسم الأيوباك | كبريتات البوتاسيوم |
| الصيغة الجزيئية | K2SO3 |
| CAS رقم | 10117-38-1 |
| المرادفات | كبريتيت ثنائي البوتاسيوم. ملح ثنائي البوتاسيوم من حامض الكبريتيك. سلفونات البوتاسيوم. أكسيد الكبريت والبوتاسيوم |
| إنتشي | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
كبريتات البوتاسيوم
صيغة كبريتات البوتاسيوم
كبريتيت البوتاسيوم له الصيغة الكيميائية K2SO3، مما يدل على أنه يحتوي على ذرتين بوتاسيوم، وذرة كبريت واحدة، وثلاث ذرات أكسجين. يتكون المركب من التفاعل بين هيدروكسيد البوتاسيوم (KOH) وثاني أكسيد الكبريت (SO2). كبريتيت البوتاسيوم هو مركب أيوني، وهذا يعني أنه يتكون من أيونات البوتاسيوم موجبة الشحنة وأيونات كبريتيت سالبة الشحنة. صيغة أيون الكبريتيت هي SO32-.
كبريتات البوتاسيوم الكتلة المولية
الكتلة المولية لـ K2SO3 هي 158.26 جم / مول. يتم حساب ذلك عن طريق إضافة الكتل الذرية لكل عنصر في الصيغة (2 × الكتلة الذرية لـ K) + الكتلة الذرية لـ S + (3 × الكتلة الذرية لـ O). تعتبر الكتلة المولية للمركب مهمة لأنها تساعد في حساب كمية المركب اللازمة لتفاعل معين أو تحديد تركيز المحلول.
نقطة غليان كبريتيت البوتاسيوم
ليس لدى K2SO3 نقطة غليان محددة لأنه يتحلل قبل الوصول إلى نقطة الغليان. ومع ذلك، عند تسخينه، يخضع K2SO3 للتحلل الحراري لتكوين كبريتات البوتاسيوم (K2SO4) وثاني أكسيد الكبريت (SO2). درجة حرارة التحلل حوالي 390 درجة مئوية.
نقطة انصهار كبريتات البوتاسيوم
تبلغ نقطة انصهار K2SO3 حوالي 350 درجة مئوية. عند درجة الحرارة هذه، يتحول المركب الصلب إلى سائل. ومع ذلك، مع ارتفاع درجة الحرارة، يتحلل K2SO3، كما ذكرنا سابقًا.
كثافة كبريتات البوتاسيوم جم/مل
تبلغ كثافة K2SO3 2.44 جم / مل عند درجة حرارة الغرفة. يتم تعريف الكثافة على أنها كتلة المادة لكل وحدة حجم. تشير الكثافة العالية لـ K2SO3 إلى أنه مركب ثقيل نسبيًا. هذه الخاصية مهمة في تحديد الخواص الفيزيائية للمركب، مثل قابليته للذوبان والتفاعلية.
الوزن الجزيئي لكبريتات البوتاسيوم
الوزن الجزيئي لـ K2SO3 هو 158.26 جم / مول. تمثل هذه القيمة متوسط كتلة جزيء المركب. الوزن الجزيئي مهم لحساب كمية المادة في حجم أو كتلة معينة، وهو مفيد في التفاعلات الكيميائية والتجارب المعملية.
هيكل كبريتات البوتاسيوم
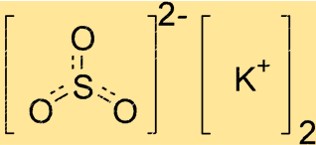
يحتوي K2SO3 على بنية بلورية، مما يعني أن ذراته مرتبة بنمط متكرر. يمتلك المركب هندسة مستوية مثلثية، حيث توجد ذرة الكبريت في المركز وذرات الأكسجين الثلاث مرتبة بشكل متماثل حولها. وتقع أيونات البوتاسيوم خارج هذا الهيكل، مما يوازن الشحنة السالبة لأيونات الكبريتيت.
ذوبان كبريتيت البوتاسيوم
K2SO3 قابل للذوبان بدرجة عالية في الماء. في درجة حرارة الغرفة، قد يذوب في الماء ليشكل محلولًا شفافًا عديم اللون. ترجع قابلية ذوبان K2SO3 إلى طبيعته الأيونية، والتي تسمح له بالتفكك إلى الأيونات المكونة له في الماء. تتأثر قابلية ذوبان K2SO3 أيضًا بدرجة الحرارة، حيث تزداد قابلية الذوبان مع زيادة درجة الحرارة.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 2.44 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 158.26 جرام/مول |
| كثافة | 2.44 جم/مل |
| نقطة الانصهار | 350 درجة مئوية |
| نقطة الغليان | يتحلل عند 390 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في الإيثانول والجلسرين |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 10.3 (لحمض الكبريتيك) |
| الرقم الهيدروجيني | ~9 (لمحلول 0.1 م) |
سلامة ومخاطر كبريتات البوتاسيوم
يعتبر K2SO3 آمنًا نسبيًا في التعامل معه واستخدامه إذا تم اتخاذ الاحتياطات المناسبة. ومع ذلك، فإنه يمكن أن يشكل خطرا إذا لم يتم التعامل معه بعناية. قد يسبب المركب تهيجًا للجلد والعينين والجهاز التنفسي إذا لامس هذه الأجزاء من الجسم. يمكن أن يسبب K2SO3 أيضًا مشاكل في الجهاز الهضمي إذا تم تناوله. بالإضافة إلى ذلك، يشكل المركب خطرًا محتملاً للحريق والانفجار عند تعرضه للحرارة أو اللهب. ولذلك يجب اتخاذ تدابير السلامة المناسبة عند العمل مع K2SO3، مثل ارتداء معدات الحماية وتخزين المركب بعيدا عن الحرارة ومصادر الاشتعال.
| رموز الخطر | جمجمة وعظمتين متقاطعتين |
| وصف الأمان | سامة، ضارة إذا ابتلع، مهيجة للجلد والعينين |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 2697 |
| رمز النظام المنسق | 283210 |
| فئة الخطر | 6.1 (المواد السامة) |
| مجموعة التعبئة | الثاني (خطر متوسط) |
| تسمم | عن طريق الفم (LD50): 345 ملغم/كغم (الفئران) |
طرق تصنيع كبريتيت البوتاسيوم
يمكن تصنيع K2SO3 بطرق مختلفة، بما في ذلك تفاعل هيدروكسيد البوتاسيوم مع ثاني أكسيد الكبريت أو الكبريت، وتفاعل كربونات البوتاسيوم مع ثاني أكسيد الكبريت، وتفاعل ثنائي كبريتيت البوتاسيوم مع هيدروكسيد. البوتاسيوم.
في الطريقة الأولى يتفاعل محلول هيدروكسيد البوتاسيوم مع غاز ثاني أكسيد الكبريت في وجود الماء لتكوين K2SO3. وفي الطريقة الثانية، يتم تسخين خليط من كربونات البوتاسيوم وثاني أكسيد الكبريت إلى درجات حرارة عالية لإنتاج K2SO3. الطريقة الثالثة تتضمن خلط ثنائي كبريتيت البوتاسيوم مع هيدروكسيد البوتاسيوم لإنتاج K2SO3 والماء.
طريقة أخرى شائعة لتصنيع K2SO3 هي تفاعل ثاني أكسيد الكبريت مع ملح البوتاسيوم، مثل كلوريد البوتاسيوم، في وجود عوامل اختزال مثل هيدروكبريتيت الصوديوم أو كبريتات الحديد (II). تُستخدم هذه الطريقة غالبًا في البيئات الصناعية لإنتاج كميات كبيرة من K2SO3.
استخدامات كبريتيت البوتاسيوم
لدى K2SO3 العديد من التطبيقات في صناعات مختلفة بسبب خصائصه الكيميائية. فيما يلي بعض الاستخدامات الشائعة لـ K2SO3:
- صناعة الأغذية والمشروبات: تستخدم كمادة حافظة للأغذية لمنع تلف وتغير لون الأطعمة مثل النبيذ والفواكه المجففة والروبيان.
- التصوير الفوتوغرافي: يستخدم كعامل تثبيت للصور الفوتوغرافية لمنع المزيد من تطوير الفيلم وجعل الصورة دائمة.
- معالجة المياه: يستخدم كعامل اختزال لإزالة الكلور من الماء ومعالجة مياه الصرف الصحي.
- صناعة الورق: يستخدم كعامل تبييض لإزالة الشوائب وتبييض اللب في عملية صناعة الورق.
- صناعة النسيج: يستخدم كعامل اختزال لإزالة الصبغة الزائدة من الأقمشة ولتبييض المنسوجات.
- الصناعة الكيميائية: تستخدم كعامل اختزال في التفاعلات الكيميائية لتحويل العوامل المؤكسدة إلى عوامل اختزال.
- الصناعة الطبية: يستخدم في بعض العلاجات الطبية لمنع أو تخفيف أعراض حالات معينة.
أسئلة:
س: ما هي صيغة كبريتات البوتاسيوم؟
ج: صيغة كبريتيت البوتاسيوم هي K2SO3.
س: هل كبريتات البوتاسيوم كبريتيت؟
ج: لا، كبريتات البوتاسيوم ليست كبريتيت. وهو ملح يتكون من البوتاسيوم والكبريت والأكسجين وصيغته الكيميائية K2SO4.
س: ما الملح الناتج من تفاعل H2SO4 مع NaOH؟ K2SO3، Na2SO4، Na2SO3، K2SO4
ج: عندما يتفاعل H2SO4 مع NaOH، فإن الملح الناتج هو Na2SO4.
س: ما عدد أيونات SO32 الموجودة في 99.6 ملجم من Na2SO3؟
الكتلة المولية لـ Na2SO3 هي 126.05 جم/مول. ج: لحساب عدد أيونات SO32-، نحتاج أولاً إلى إيجاد عدد مولات Na2SO3: 99.6 مجم / 126.05 جم/مول = 0.000789 مول. بما أن Na2SO3 يحتوي على أيوني SO32- لكل جزيء، فإن عدد أيونات SO32- في 0.000789 مول من Na2SO3 هو 0.000789 مول × 2 = 0.00158 مول. لذلك، هناك 0.00158 مول × 6.022 × 10^23 أيونات/مول = 9.52 × 10^20 SO32- أيونات في 99.6 مجم من Na2SO3.
س: ما عدد أيونات الصوديوم الموجودة في 99.6 ملجم من Na2SO3؟ الكتلة المولية لـ Na2SO3 هي 126.05 جم/مول.
ج: لحساب عدد أيونات الصوديوم، نحتاج أولاً إلى إيجاد عدد مولات Na2SO3: 99.6 مجم / 126.05 جم/مول = 0.000789 مول. بما أن كل جزيء من Na2SO3 يحتوي على أيوني صوديوم، فإن عدد أيونات الصوديوم في 0.000789 مول من Na2SO3 هو 0.000789 مول × 2 = 0.00158 مول. لذلك، يوجد 0.00158 مول × 6.022 × 10^23 أيونات/مول = 9.52 × 10^20 أيونات صوديوم في 99.6 مجم من Na2SO3.
س: ما هو الاسم الكيميائي لـ Na2SO3؟
ج: الاسم الكيميائي لـ Na2SO3 هو كبريتات الصوديوم.
س: ما اسم المركب الذي صيغته Na2SO3؟
ج: اسم المركب الذي صيغته Na2SO3 هو كبريتيت الصوديوم.
