كبريتات الأمونيوم ((NH4)2SO4) هي سماد يستخدم على نطاق واسع ويوفر العناصر الغذائية الأساسية للنباتات. كما أنه يستخدم في مثبطات اللهب، وفي تنقية البروتين وكمضافات غذائية.
| اسم الأيوباك | رباعي أوكسوسلفات الأمونيوم (VI) |
| الصيغة الجزيئية | (NH4) 2SO4 |
| CAS رقم | 7783-20-2 |
| المرادفات | كبريتات الأمونيوم، كبريتات الأمونيوم (2: 1)، كبريتات الأمونيوم، ملح حمض الكبريتيك ثنائي الأمونيوم، ماسكاجنيت، أكتاماستر، دولامين |
| إنتشي | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
خصائص كبريتات الأمونيوم
صيغة كبريتات الأمونيوم
صيغة كبريتات الأمونيوم هي (NH4)2SO4. وهذا يعني أن جزيء واحد من كبريتات الأمونيوم يحتوي على أيوني أمونيوم (NH4)+ وأيون كبريتات واحد (SO4)2-. ترتبط أيونات الأمونيوم وأيونات الكبريتات معًا بواسطة روابط أيونية.
كبريتات الأمونيوم الكتلة المولية
الكتلة المولية لـ (NH4)2SO4 هي 132.14 جم/مول. لحساب الكتلة المولية، علينا جمع الكتل الذرية لجميع الذرات في الصيغة. الكتل الذرية هي :
- النيتروجين: 14.01 جم/مول
- الهيدروجين: 1.01 جم/مول
- الكبريت: 32.06 جم/مول
- الأكسجين: 16.00 جم/مول
وبالتالي، فإن الكتلة المولية لـ (NH4)2SO4 هي:
(2 × 14.01) + (8 × 1.01) + 32.06 + (4 × 16.00) = 132.14 جم / مول
درجة غليان كبريتات الأمونيوم
درجة غليان (NH4)2SO4 غير محددة بشكل جيد لأنها تتحلل قبل الوصول إلى نقطة الغليان. عند تسخينه فوق 235 درجة مئوية، يبدأ (NH4)2SO4 في فقدان الماء وتكوين ثنائي كبريتات الأمونيوم (NH4)HSO4. عند تسخينه فوق 280 درجة مئوية، يتحلل ثنائي كبريتات الأمونيوم إلى الأمونيا (NH3) وحمض الكبريتيك (H2SO4).
نقطة انصهار كبريتات الأمونيوم
نقطة انصهار (NH4)2SO4 هي 235 درجة مئوية. هذه هي درجة الحرارة التي يتغير عندها (NH4)2SO4 من الحالة الصلبة إلى الحالة السائلة. ومع ذلك، كما ذكر أعلاه، (NH4)2SO4 يبدأ أيضًا في التحلل عند درجة الحرارة هذه، لذلك فهو ليس مرحلة سائلة نقية.
كثافة كبريتات الأمونيوم جم/مل
تبلغ كثافة (NH4)2SO4 1.77 جم / مل عند درجة حرارة الغرفة والضغط. وهذا يعني أن الملليلتر الواحد من (NH4)2SO4 يزن 1.77 جرام. تعتمد كثافة المادة على درجة حرارتها وضغطها، لذلك يمكن أن تختلف قليلاً في ظل ظروف مختلفة.
الوزن الجزيئي لكبريتات الأمونيوم
الوزن الجزيئي لـ (NH4)2SO4 هو نفس كتلته المولية، وهي 132.14 جم/مول. الوزن الجزيئي هو كتلة مول واحد من المادة، وهو ما يساوي 6.022 × 10^23 جزيء. يمكن أيضًا التعبير عن الوزن الجزيئي بوحدات الكتلة الذرية (amu)، والتي تساوي 1/12 كتلة ذرة الكربون-12. في amu، الوزن الجزيئي لـ (NH4)2SO4 هو 132.14 amu.
هيكل كبريتات الأمونيوم
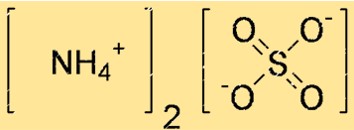
يمكن تمثيل بنية (NH4)2SO4 ببنية نقطة لويس أو نموذج الكرة والعصا. يُظهر هيكل نقطة لويس إلكترونات التكافؤ لكل ذرة والروابط بينها. يوضح نموذج الكرة والعصا شكل وحجم كل ذرة والروابط بينها.
في الهيكل أعلاه، تمثل الخطوط المزدوجة (=) روابط مزدوجة، والخطوط المفردة (-) تمثل روابط فردية، والنقاط (.) تمثل أزواجًا وحيدة من الإلكترونات.
ذوبان كبريتات الأمونيوم
قابلية ذوبان (NH4)2SO4 هي كمية (NH4)2SO4 التي يمكن أن تذوب في كمية معينة من الماء عند درجة حرارة معينة. تزداد ذوبان (NH4)2SO4 مع زيادة درجة الحرارة، كما هو مبين في البيانات التالية:
| درجة الحرارة (درجة مئوية) | الذوبان (جم/100 مل من الماء) |
| 0 | 70.6 |
| مظهر | حبيبات أو بلورات بيضاء ناعمة |
| كثافة محددة | 1.77 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 132.14 جرام/مول |
| كثافة | 1.77 جم/سم3 |
| نقطة الانصهار | 235 إلى 280 درجة مئوية (تتحلل) |
| نقطة الغليان | لا ينطبق (متحللة) |
| نقطة فلاش | غير قابل للاشتعال |
| الذوبان في الماء | 70.6 جرام لكل 100 جرام ماء (0 درجة مئوية)، 74.4 جرام لكل 100 جرام ماء (20 درجة مئوية)، 103.8 جرام لكل 100 جرام ماء (100 درجة مئوية) |
| الذوبان | غير قابل للذوبان في الأسيتون والكحول والأثير |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 5.5 (لأيون الأمونيوم) |
| الرقم الهيدروجيني | 5 إلى 6 (لمحلول 5٪) |
سلامة ومخاطر كبريتات الأمونيوم
(NH4)2SO4 لا يشكل خطورة كبيرة على صحة الإنسان، ولكنه قد يسبب تهيج الجلد والعينين والأنف والحنجرة في حالة ملامسته أو استنشاقه. قد يسبب أيضًا الغثيان وآلام المعدة والإسهال والقيء والنعاس في حالة تناوله. إنه ضار بالحياة المائية ويجب تجنب إطلاقه في البيئة. ويتحلل عند تسخينه فوق 235 درجة مئوية، مكونًا غازات سامة مثل الأمونيا وحمض الكبريتيك. ومن المعترف به عمومًا أنه آمن كمضاف غذائي، ولكنه قد يسبب تفاعلات حساسية أو أعراض الربو لدى بعض الأشخاص.
| رموز الخطر | ليس من الضروري |
| وصف الأمان | تجنب إطلاقها في البيئة. تخلص من المحتويات/الحاوية إلى منشأة معتمدة للتخلص من النفايات. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 31022100 |
| فئة الخطر | غير قابل للتطبيق |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران) = 2.840 ملغم/كغم |
طرق تصنيع كبريتات الأمونيوم
(NH4)2SO4 يمكن تصنيعه بطرق مختلفة لأنه ملح غير عضوي. بعض الطرق الشائعة هي:
- تحييد الأمونيا وحمض الكبريتيك: تتضمن هذه الطريقة خلط غاز الأمونيا أو محلول مائي مع حامض الكبريتيك وتبخير الماء للحصول على بلورات (NH4)2SO4.
2NH3 + H2SO4 -> (NH4)2SO4
- تفاعل كربونات الأمونيوم والجبس: تتضمن هذه الطريقة إضافة الجبس المقسم بشكل ناعم ( كبريتات الكالسيوم ) إلى محلول كربونات الأمونيوم وتصفية راسب كربونات الكالسيوم.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- منتج ثانوي لعمليات أخرى: يمكن للعمليات الصناعية المختلفة، مثل تنقية غاز فرن فحم الكوك، وإنتاج الكابرولاكتام، وتكرير النيكل، وإزالة الكبريت من غاز المداخن، أن تنتج (NH4)2SO4 كمنتج ثانوي. تستخدم هذه العمليات الأمونيا أو مركبات الأمونيوم لإزالة الكبريت أو الشوائب الأخرى من تيارات الغاز، مما يؤدي إلى (NH4)2SO4 كنفايات أو منتج ذي قيمة.
استخدامات كبريتات الأمونيوم
(NH4)2SO4 هو ملح غير عضوي له استخدامات مختلفة، مثل:
- سماد التربة القلوي: (NH4)2SO4 يخفض درجة حموضة التربة ويوفر النيتروجين والكبريت لنمو النبات. وهي مناسبة للمحاصيل التي تتطلب تربة حمضية، مثل التوت الأزرق والبطاطس والطماطم.
- مساعد الرش الزراعي: (NH4)2SO4 يحسن فعالية المبيدات الحشرية القابلة للذوبان في الماء ومبيدات الأعشاب ومبيدات الفطريات عن طريق ربط أيونات الحديد والكالسيوم التي يمكن أن تتداخل مع عملها. كما أنه يحسن امتصاص الغليفوسات ومبيدات الأعشاب الجهازية الأخرى بواسطة النباتات.
- تنقية البروتين: يمكن لـ (NH4)2SO4 ترسيب البروتينات من المحاليل المائية عن طريق زيادة القوة الأيونية وتقليل قابلية ذوبان البروتين. يمكن استخدام طريقة التمليح لفصل البروتينات بناءً على حجمها وشحنتها وكراهيتها للماء.
- المضافات الغذائية: تستخدم المنتجات الغذائية المختلفة مثل الخبز والجبن والنبيذ والخضروات المعلبة (NH4) 2SO4 كمنظم للحموضة ومكيف العجين ومغذي الخميرة وعامل ثبات. تعترف إدارة الغذاء والدواء الأمريكية بأنها آمنة بشكل عام.
- استخدامات أخرى: يمكن استخدام (NH4)2SO4 في صناعة أملاح الأمونيوم الأخرى، وطفايات الحريق، ومثبطات اللهب، ودباغة الجلود، وصباغة المنسوجات، والطلاء الكهربائي للمعادن، والكيمياء التحليلية.
أسئلة:
س: ما هي الصيغة الكيميائية لكبريتات الأمونيوم؟
ج: الصيغة الكيميائية لكبريتات الأمونيوم هي (NH4)2SO4. وهذا يعني أن جزيء واحد من كبريتات الأمونيوم يحتوي على أيوني أمونيوم (NH4)+ وأيون كبريتات واحد (SO4)2-.
س: هل كبريتات الأمونيوم قابلة للذوبان؟
ج: (NH4)2SO4 قابل للذوبان في الماء، ولكنه غير قابل للذوبان في الأسيتون والكحول والأثير. يمكنه إذابة 70.6 جرامًا لكل 100 جرام ماء عند 0 درجة مئوية، و74.4 جرامًا لكل 100 جرام ماء عند 20 درجة مئوية، و103.8 جرامًا لكل 100 جرام ماء عند 100 درجة مئوية.
س: ما هي كمية كبريتات الأمونيوم لكل جالون من الماء؟
ج: تعتمد كمية (NH4)2SO4 لكل جالون من الماء على التركيز المطلوب ودرجة حرارة الماء. على سبيل المثال، إذا كان التركيز المطلوب هو 10% (وزن/حجم) ودرجة حرارة الماء 20 درجة مئوية، فإن كمية (NH4)2SO4 لكل جالون من الماء هي:
10% (وزن/حجم) = 10 جرام لكل 100 مل من الماء 1 جالون = 3785.41 مل 10 جرام × 3785.41 مل / 100 مل = 378.54 جرام، وبالتالي فإن كمية (NH4)2SO4 لكل جالون من الماء هي 378.54 جرام.
س: هل يحدث تفاعل عند اتحاد المحاليل المائية لكبريتات الأمونيوم وكلوريد الكالسيوم؟
ج: لا، لا يحدث تفاعل عند اتحاد المحاليل المائية لـ (NH4)2SO4 وكلوريد الكالسيوم. وبالفعل فإن الملحين قابلان للذوبان في الماء ولا يشكلان أي راسب غير قابل للذوبان. يحتوي المحلول الناتج على أربعة أيونات: الأمونيوم (NH4)+، والكبريتات (SO4)2-، والكالسيوم (Ca2+)، والكلوريد (Cl)-.
س: كيفية ترسيب البروتينات بكبريتات الأمونيوم؟
ج: لترسيب البروتينات بـ (NH4)2SO4 يمكن اتباع الخطوات التالية:
- تحضير محلول مائي من (NH4)2SO4 معلوم التركيز والحجم.
- يضاف محلول البروتين إلى محلول (NH4)2SO4 ببطء مع التحريك.
- مراقبة التعكر أو الكثافة البصرية للخليط لتحديد كمية هطول البروتين.
- الطرد المركزي الخليط لفصل بيليه البروتين من المادة طافية.
- تخلص من المادة طافية واغسل بيليه البروتين بالمحلول العازل أو الماء لإزالة الملح الزائد.
- إعادة تعليق أو إذابة بيليه البروتين في المخزن المؤقت المناسب لمزيد من التحليل أو الاستخدام.
س: كم جرام يوجد في 6.90 جزيء من كبريتات الأمونيوم؟
ج: لمعرفة عدد الجرامات الموجودة في 6.90 جزيء من (NH4)2SO4، نحتاج إلى استخدام عدد أفوجادرو والكتلة المولية لـ (NH4)2SO4. رقم أفوجادرو هو 6.022 × 10^23، مما يعني أن المول الواحد من أي مادة يحتوي على هذا العدد من الجزيئات. الكتلة المولية لـ (NH4)2SO4 هي 132.14 جم/مول، مما يعني أن مولًا واحدًا من (NH4)2SO4 يزن هذا العدد من الجرامات. لذلك، يمكننا استخدام هذه الصيغة لحساب عدد الجرامات الموجودة في 6.90 جزيء من (NH4)2SO4:
جرام = الجزيئات × الكتلة المولية / عدد أفوجادرو جرام = 6.90 × 132.14 / 6.022 × 10^23 جرام = 1.52 × 10^-21 لذلك، يوجد 1.52 × 10^-21 جرام في 6.90 جزيء من (NH4)2SO4.
س: ما مقدار الكبريت الموجود في كبريتات الأمونيوم؟
ج: (NH4)2SO4 يحتوي على 24% كبريت بالكتلة. ويمكن حساب ذلك باستخدام صيغة التركيب المئوية والكتل المولية للكبريت و(NH4)2SO4. الكتلة المولية للكبريت هي 32.06 جم/مول والكتلة المولية لـ (NH4)2SO4 هي 132.14 جم/مول. وبالتالي فإن نسبة الكبريت في (NH4)2SO4 هي:
النسبة المئوية = الكتلة المولية للكبريت × 100 / الكتلة المولية لكبريتات الأمونيوم النسبة = 32.06 × 100 / 132.14 النسبة المئوية = 24.26٪
س: أي من هذه الأملاح يعتبر ملحاً متعادلاً؟ na2so4 nacn kf (nh4)2so4
ج: الملح المتعادل هو الذي لا يؤثر على درجة حموضة المحلول عند إذابته في الماء. ويتكون من تفاعل حمض قوي وقاعدة قوية. من بين الأملاح الأربعة المذكورة، Na2so4 فقط هو ملح متعادل. ويتكون من تفاعل هيدروكسيد الصوديوم (قاعدة قوية) وحمض الكبريتيك (حمض قوي). الأملاح الأخرى إما حمضية أو قاعدية. Nacn هو ملح أساسي، يتكون من تفاعل هيدروكسيد الصوديوم (قاعدة قوية) وحمض الهيدروسيانيك (حمض ضعيف). Kf هو ملح قاعدي، يتكون من تفاعل هيدروكسيد البوتاسيوم (قاعدة قوية) وحمض الهيدروفلوريك (حمض ضعيف). (Nh4)2so4 هو ملح حمضي، يتكون من تفاعل هيدروكسيد الأمونيوم (قاعدة ضعيفة) وحمض الكبريتيك (حمض قوي).
س: ما هي الكتلة المولية لـ (nh4)2so4؟
ج: الكتلة المولية لـ (nh4)2so4 هي 132.14 جم/مول. للعثور على الكتلة المولية، علينا جمع الكتل الذرية لجميع الذرات في الصيغة. الكتل الذرية هي :
- النيتروجين: 14.01 جم/مول
- الهيدروجين: 1.01 جم/مول
- الكبريت: 32.06 جم/مول
- الأكسجين: 16.00 جم/مول
وبالتالي، فإن الكتلة المولية لـ (nh4)2so4 هي:
(2 × 14.01) + (8 × 1.01) + 32.06 + (4 × 16.00) = 132.14 جم/مول
س: هل (nh4)2so4 قابل للذوبان في الماء؟
ج: نعم، (nh4)2so4 قابل للذوبان في الماء. يمكنه إذابة ما يصل إلى 70.6 جرامًا لكل 100 جرام من الماء عند 0 درجة مئوية، و74.4 جرامًا لكل 100 جرام من الماء عند 20 درجة مئوية، و103.8 جرامًا لكل 100 جرام من الماء عند 100 درجة مئوية.
