كبريتات الأمونيوم ((NH4)2S2O8) عبارة عن مسحوق أبيض. يذوب في الماء ويطلق الأكسجين. قد يبيض أو يحفر أو يبدأ البلمرة.
| اسم الأيوباك | بيروكسيد ثنائي كبريتات الأمونيوم |
| الصيغة الجزيئية | (NH4)2S2O8 |
| CAS رقم | 7727-54-0 |
| المرادفات | كبريتات الأمونيوم، بيروكسوديكبريتات الأمونيوم، كبريتات ثنائي الأمونيوم، بيروكسيد ثنائي كبريتات الأمونيوم |
| إنتشي | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
خصائص كبريتات الأمونيوم
صيغة كبريتات الأمونيوم
صيغة كبريتات الأمونيوم هي (NH4)2S2O8. وهو يتألف من كاتيونين من الأمونيوم (NH4+) وأنيون واحد فوق كبريتات (S2O82-). يحتوي أنيون الكبريتات على مجموعتين كبريتات (SO42-) متصلتين بواسطة رابطة بيروكسيد (OO).
كبريتات الأمونيوم الكتلة المولية
الكتلة المولية لـ (NH4)2S2O8 هي 228.18 جم/مول. يتم حساب ذلك عن طريق جمع الكتل الذرية لجميع الذرات في الصيغة: 2 × 14.01 (N) + 8 × 1.01 (H) + 2 × 32.06 (S) + 8 × 16.00 (O).
نقطة غليان كبريتات الأمونيوم
(NH4)2S2O8 ليس لديه نقطة غليان لأنه يتحلل قبل الوصول إلى درجة الحرارة هذه. يتحلل عند حوالي 120 درجة مئوية (248 درجة فهرنهايت) إلى الأمونيا والنيتروجين والأكسجين والماء. رد فعل التحلل هو:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
نقطة انصهار كبريتات الأمونيوم
(NH4) 2S2O8 ليس له نقطة انصهار لأنه يتحلل قبل الوصول إلى درجة الحرارة هذه. يتحلل عند حوالي 120 درجة مئوية (248 درجة فهرنهايت) إلى الأمونيا والنيتروجين والأكسجين والماء. رد فعل التحلل هو:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
كثافة كبريتات الأمونيوم جم/مل
تبلغ كثافة (NH4) 2S2O8 1.98 جم / مل عند 25 درجة مئوية. وهذا يعني أن الملليلتر الواحد من (NH4)2S2O8 يزن 1.98 جرام.
الوزن الجزيئي لكبريتات الأمونيوم
الوزن الجزيئي لـ (NH4)2S2O8 هو نفس كتلته المولية، وهي 228.18 جم/مول. وهذا يعني أن المول الواحد من (NH4)2S2O8 يزن 228.18 جرامًا.
هيكل كبريتات الأمونيوم
يمكن تمثيل بنية (NH4)2S2O8 ببنية لويس التالية:
س
|| ||
O=S||-OOS||=O
|| ||
س
/\
نيو هامبشاير نيو هامبشاير
\/
ح
/\
نيو هامبشاير نيو هامبشاير
\/
ح
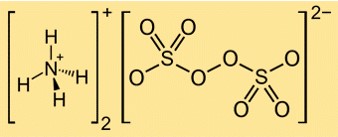
في هذا الهيكل، ترتبط كل ذرة كبريت بأربع ذرات أكسجين في هندسة رباعية السطوح، وكل ذرة أكسجين تحتوي على زوجين من الإلكترونات الحرة. الرابطة البيروكسيدية بين مجموعتي الكبريتات هي رابطة واحدة تحتوي على زوج واحد من الإلكترونات. تتشكل كاتيونات الأمونيوم من ذرات النيتروجين التي تتقاسم ثلاثة إلكترونات مع ثلاث ذرات هيدروجين لكل منها ولها شحنة موجبة.
ذوبان كبريتات الأمونيوم
(NH4)2S2O8 قابل للذوبان بدرجة عالية في الماء، أكثر بكثير من ملح البوتاسيوم المرتبط به 1 . وهو يذوب في الماء لتكوين أيونات الأمونيوم وأيونات الكبريتات، والتي يمكن أن تتفكك أكثر إلى جذور الكبريتات:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
تزداد ذوبان (NH4)2S2O8 في الماء مع زيادة درجة الحرارة. عند درجة حرارة 25 درجة مئوية، يمكنه إذابة ما يصل إلى 80 جم/100 مل من الماء. كما أنه قابل للذوبان بشكل معتدل في الميثانول.
| مظهر | الأبيض إلى بلورات صفراء |
| كثافة محددة | 1.98 |
| لون | أبيض إلى مصفر |
| يشم | حلوة وغير سارة |
| الكتلة المولية | 228.18 جرام/مول |
| كثافة | 1.98 جم/مل عند 25 درجة مئوية |
| نقطة الانصهار | 120 درجة مئوية (تتحلل) |
| نقطة الغليان | غير متوفر (متحللة) |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | 80 جم/100 مل عند 25 درجة مئوية |
| الذوبان | قابل للذوبان بشكل معتدل في MeOH |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | لا يوجد |
السلامة ومخاطر كبريتات الأمونيوم
(NH4)2S2O8 هو عامل مؤكسد قوي يمكنه تكثيف النار والتفاعل بشكل انفجاري مع المواد القابلة للاحتراق. يمكن أن يسبب أيضًا تأثيرات صحية مختلفة في حالة تناوله أو استنشاقه أو ملامسته للجلد أو العينين. يمكن أن يهيج الجلد والعينين والأنف والحنجرة والرئتين. وقد يسبب أيضًا تفاعلات حساسية مثل الطفح الجلدي أو الربو أو صعوبة التنفس. إنه ضار بالحياة المائية. ولذلك يجب التعامل معها بحذر وباستخدام معدات الحماية المناسبة. ويجب تخزينه بعيدًا عن الحرارة والشرر واللهب وأي مواد أخرى غير متوافقة.
| رموز الخطر | O (مؤكسد)، Xn (ضار)، Xi (مهيج) |
| وصف الأمان | S17 (الابتعاد عن المواد القابلة للاحتراق)، S26 (في حالة ملامسة العينين، اشطفها فورًا بكمية كبيرة من الماء واستشر الطبيب)، S36/37/39 (ارتداء الملابس الواقية المناسبة والقفازات وحماية العين/الوجه)، S45 (في حالة وقوع حادث أو إذا شعرت بالتوعك، اطلب العناية الطبية على الفور) |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1444 |
| رمز النظام المنسق | 28334000 |
| فئة الخطر | 5.1 (المواد المؤكسدة) |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة المتوسطة للفئران عن طريق الفم: 689 مجم/كجم، الجرعة المميتة المتوسطة للفئران عن طريق الاستنشاق: 2.95 مجم/لتر/4 ساعات، الجرعة المميتة المتوسطة عن طريق الجلد: 2000 مجم/كجم |
طرق تصنيع كبريتات الأمونيوم
يمكن استخدام طرق مختلفة لتحضير (NH4)2S2O8، وهو ملح غير عضوي.
تتضمن إحدى الطرق الأكثر شيوعًا التحليل الكهربائي لمحلول بارد ومركّز من كبريتات الأمونيوم ((NH4)2SO4) وحمض الكبريتيك (H2SO4) .
تم وصف هذه الطريقة لأول مرة بواسطة هيو مارشال. يتضمن التحليل الكهربائي تمرير تيار كهربائي عبر المحلول باستخدام أنود البلاتين وكاثود الفضة المسامي.
عند الأنود، ينتج التحليل الكهربائي لحمض الكبريتيك أيونات كبريتات الهيدروجين HSO4-، والتي تتحد مع الماء لتكوين أيونات فوق الكبريتات S2O82- وغاز الهيدروجين H2. عند الكاثود، يخضع غاز الأكسجين O2 للاختزال لإنتاج بيروكسيد الهيدروجين H2O2، الذي يتفاعل مع أيونات الأمونيوم NH4+ لتكوين (NH4)2S2O8 (NH4)2S2O8 والماء H2O.
رد الفعل العام هو كما يلي:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
عن طريق التبريد والترشيح، يمكن تبلور (NH4)2S2O8 من محلول الإلكتروليت.
طريقة أخرى لتحضير (NH4)2S2O8 هي أكسدة ثنائي كبريتات الأمونيوم NH4HSO4 مع الأوزون O3 أو بيروكسيد الهيدروجين H2O2 . تنتج هذه الطريقة إنتاجية ونقاء أعلى لـ (NH4)2S2O8 مقارنة بطريقة التحليل الكهربائي. رد الفعل هو:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
ذهب
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
استخدامات كبريتات الأمونيوم
(NH4)2S2O8 هي مادة كيميائية متعددة الاستخدامات لها العديد من الاستخدامات في مختلف الصناعات والتطبيقات. بعض الاستخدامات الأكثر شيوعًا هي:
- وهو بمثابة عامل تبييض وسلائف كيميائية في تركيب مركبات أخرى ذات أهمية صناعية.
- إنه يبدأ عملية البلمرة ويستخدمه المصنعون بشكل أساسي في إنتاج البوليسترين.
- يستخدمه مصنعو ثنائي الفينيل متعدد الكلور كأداة نقش لإزالة النحاس والمعادن الأخرى من السطح.
- تستخدم صناعة أشباه الموصلات أيضًا (NH4) 2S2O8 كمنظف لتنظيف وتلميع رقائق السيليكون.
- تستخدمه المختبرات كعامل تنظيف ومطهر للمعدات والأواني الزجاجية وأنظمة المياه.
- يمنع تحول لون الفواكه والخضروات إلى اللون البني، مما يجعله مادة مضافة تستخدم لحفظ الأطعمة.
- تستخدمه التفاعلات الكيميائية المختلفة كعامل مؤكسد لتخليق البيروكسيدات العضوية والسلفونات والسلفوناميدات.
- تستخدمه البطاريات كمزيل للاستقطاب لزيادة أدائها وعمرها.
- تستخدمه مبيضات الشعر كمكون شائع لتفتيح لون الشعر عن طريق أكسدة صبغة الميلانين.
أسئلة:
س: كم من الوقت تستمر كبريتات الأمونيوم؟
ج: (NH4)2S2O8 مركب مستقر يمكن تخزينه إلى أجل غير مسمى في الحالة الصلبة دون تحلل. ومع ذلك، فإنه قد يفقد فعاليته مع مرور الوقت عندما يذوب في الماء. تبلغ فترة صلاحية محلول 10% من (NH4)2S2O8 حوالي 2 إلى 4 أسابيع عند درجة حرارة الغرفة ومن 2 إلى 3 أشهر عند 4 درجات مئوية 1 2 . يجب حماية المحلول من الضوء والحرارة وفحصه بشكل دوري للتأكد من وجود فقاعات أو رواسب تشير إلى التحلل.
س: ماذا تفعل كبريتات الأمونيوم؟
ج: (NH4) 2S2O8 هو عامل مؤكسد قوي يمكنه إطلاق جذور الأكسجين في محلول مائي. يمكن لهذه الجذور إثارة أو تسريع التفاعلات الكيميائية المختلفة، مثل البلمرة، والتبييض، والحفر، والتنظيف والتطهير. (NH4)2S2O8 يمكن أيضًا أن يعمل كمصدر لأيونات الكبريتات لتخليق المركبات الأخرى.
س: ما الذي يجب خلط كبريتات الأمونيوم فيه؟
ج: (NH4)2S2O8 شديد الذوبان في الماء ويمكن خلطه بالماء لتحضير محاليل بتركيزات مختلفة. تزداد ذوبان (NH4)2S2O8 في الماء مع زيادة درجة الحرارة. عند درجة حرارة 25 درجة مئوية، يمكنه إذابة ما يصل إلى 80 جم/100 مل من الماء. كما أنه قابل للذوبان بشكل معتدل في الميثانول. (NH4)2S2O8 لا ينبغي خلطه بمواد غير متوافقة، مثل المواد القابلة للاحتراق أو عوامل الاختزال أو المعادن أو الأحماض أو القواعد، لأنها قد تتفاعل معها بعنف أو انفجار.
س: هل بيروكسيد كبريتات الأمونيوم هو نفس كبريتات الأمونيوم؟
ج: نعم، بيروكسيد ثنائي كبريتات الأمونيوم هو اسم آخر لـ (NH4)2S2O8. كلاهما مترادفان لنفس المركب بالصيغة (NH4)2S2O8.
س: ما هي كبريتات الأمونيوم المستخدمة في SDS-PAGE؟
ج: SDS-PAGE (الرحلان الكهربي لهلام بولي أكريلاميد كبريتات دوديسيل الصوديوم) هي تقنية لفصل البروتينات بناءً على حجمها وشحنتها. (NH4)2S2O8 يستخدم كمحفز لبلمرة مونومرات الأكريلاميد والبيساكريلاميد لتشكيل مصفوفة هلامية بولي أكريلاميد. (NH4) 2S2O8 يولد الجذور الحرة التي تبدأ تفاعل الارتباط المتبادل بين المونومرات.
س: كيفية صنع 10% من كبريتات الأمونيوم؟
ج: لتحضير محلول 10% من (NH4)2S2O8، قم بوزن 10 جم من المادة الصلبة (NH4)2S2O8 وقم بإذابتها في 90 مل من الماء المقطر. يقلب حتى يذوب تماما وينقل إلى دورق حجمي سعة 100 مل. املأ حتى العلامة بالماء المقطر واخلطه جيدًا. قم بتخزين المحلول في زجاجة داكنة عند درجة حرارة 4 درجات مئوية أو درجة حرارة الغرفة.
س: كيف يمكنني إصلاح كبريتات الأمونيوم الناتجة عن القوس الكهربائي؟
ج: وميض القوس هو عيب ناتج عن قوس كهربائي يؤدي إلى إتلاف سطح المعدن. وهذا يمكن أن يقلل من قوة المعدن ومقاومته للتآكل ويؤدي إلى التشقق أو الفشل. لإصلاح وميض القوس، تتمثل إحدى الطرق في استخدام (NH4)2S2O8 كأداة نقش لإزالة المنطقة المصابة. الإجراء هو كما يلي:
- قم بتنظيف السطح المعدني بالأسيتون أو الكحول لإزالة أي أوساخ أو شحوم.
- ضع طبقة رقيقة من محلول كبريتات الأمونيوم (10-20%) على منطقة ضرب القوس باستخدام فرشاة أو قطعة قطن.
- انتظر من 5 إلى 10 دقائق حتى تظهر الفقاعات على السطح، مما يشير إلى حدوث تفاعل أكسدة.
- شطف السطح بالماء وجففه بقطعة قماش نظيفة.
- كرر العملية حتى يتم حذف الانحناء بالكامل.
- افحص السطح بحثًا عن الشقوق أو الحفر واملأها بمادة الحشو المناسبة إذا لزم الأمر.
- ضع طبقة واقية أو طلاءًا لمنع المزيد من التآكل.
س: هل كبريتات الأمونيوم مادة خافضة للتوتر السطحي؟
ج: لا، (NH4)2S2O8 ليس مادة خافضة للتوتر السطحي. الفاعل بالسطح هو مادة تقلل التوتر السطحي لسائل أو بين سائلين، ويمكن أن تشكل مذيلات أو مستحلبات. (NH4)2S2O8 لا يحتوي على هذه الخصائص. وهو عامل مؤكسد يمكنه إطلاق جذور الأكسجين في محلول مائي.
س: ما هي جوانب تجربتك التي يتم التحكم فيها بواسطة TEMED وكبريتات الأمونيوم؟
ج: يتم استخدام TEMED و(NH4)2S2O8 للتحكم في بلمرة مونومرات الأكريلاميد والبيساكريلاميد لتشكيل مصفوفة جل بولي أكريلاميد للترحيل الكهربائي. يعمل كل من TEMED و(NH4)2S2O8 كمحفزين لتوليد الجذور الحرة التي تبدأ وتسرع تفاعل الارتباط المتبادل بين المونومرات. يؤثر تركيز ونسبة TEMED و(NH4)2S2O8 على معدل واكتمال البلمرة، بالإضافة إلى حجم المسام والقوة الميكانيكية للجيل.
س: هل يتفاعل كبريتات الأمونيوم مع الهواء؟
ج: نعم، يمكن أن يتفاعل (NH4)2S2O8 مع الهواء، خاصة في الظروف الرطبة. (NH4) 2S2O8 يمكن أن يمتص الرطوبة من الهواء ويخضع للتحلل المائي، مكونًا كبريتات الأمونيوم وبيروكسيد الهيدروجين. يمكن أن يتحلل بيروكسيد الهيدروجين إلى ماء وغاز الأكسجين، مما يؤدي إلى إطلاق الحرارة والضغط. قد يتسبب ذلك في تمزق أو انفجار حاوية (NH4)2S2O8 إذا لم يتم تهويتها بشكل صحيح. يمكن أن يتفاعل (NH4)2S2O8 أيضًا مع الأكسجين الموجود في الهواء لتكوين الأوزون، وهو غاز سام. لذلك، يجب تخزين (NH4)2S2O8 في مكان بارد وجاف وجيد التهوية، بعيدًا عن الحرارة والشرر واللهب وغيرها من المواد غير المتوافقة.
