فوسفات المغنيسيوم (Mg3(PO4)2) هو مركب يتكون من أيونات المغنيسيوم والفوسفات. إنه يلعب دورًا حيويًا في العديد من العمليات البيولوجية مثل تخليق الحمض النووي ووظيفة الأعصاب وتقلص العضلات.
| اسم الأيوباك | فوسفات المغنيسيوم |
| الصيغة الجزيئية | ملغ3(PO4)2 |
| CAS رقم | 7757-87-1 |
| المرادفات | فوسفات ثلاثي المغنيسيوم، أورثوفوسفات ثلاثي المغنيسيوم، أورثوفوسفات المغنيسيوم، فوسفات المغنيسيوم الثلاثي، فوسفات المغنيسيوم ثلاثي |
| إنتشي | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
خصائص فوسفات المغنيسيوم
صيغة فوسفات المغنيسيوم
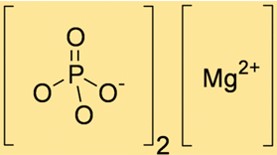
الصيغة الكيميائية لفوسفات المغنيسيوم هي Mg3(PO4)2، مما يدل على أنه يحتوي على ثلاثة أيونات Mg+2 واثنين من أيونات PO43-. تعتبر الصيغة ضرورية في الحسابات المتكافئة وتساعد في تحديد الكمية الصحيحة من المواد المتفاعلة والمنتجات في التفاعلات الكيميائية التي تتضمن Mg3(PO4)2.
فوسفات المغنيسيوم الكتلة المولية
Mg3(PO4)2 له كتلة مولية تبلغ 262.86 جم/مول. تمثل هذه القيمة كتلة مول واحد من المركب Mg3(PO4)2، وهو عبارة عن مزيج من ثلاثة أيونات Mg+2 واثنين من أيونات PO4-. الكتلة المولية هي خاصية حاسمة تستخدم في الحسابات المتكافئة لتحديد كمية Mg3(PO4)2 اللازمة في التفاعلات الكيميائية المختلفة.
نقطة غليان فوسفات المغنيسيوم
ليس لدى Mg3(PO4)2 نقطة غليان محددة لأنه يتحلل قبل الوصول إلى نقطة الغليان. عند درجات الحرارة المرتفعة، يتحلل Mg3(PO4)2 إلى أكسيد المغنسيوم وخامس أكسيد الفوسفور، اللذين تبلغ درجة غليانهما 3600 درجة مئوية و300 درجة مئوية على التوالي. تعتمد درجة حرارة تحلل Mg3(PO4)2 على عوامل مختلفة مثل التركيز ومعدل التسخين والضغط.
نقطة انصهار فوسفات المغنيسيوم
Mg3(PO4)2 لديه نقطة انصهار تبلغ 1188 درجة مئوية. عند درجة الحرارة هذه، يخضع المركب لتغير طوري من الحالة الصلبة إلى الحالة السائلة. تتأثر نقطة انصهار Mg3(PO4)2 بعوامل مختلفة، بما في ذلك الضغط والشوائب والبنية البلورية.
كثافة فوسفات المغنيسيوم جم / مل
تختلف كثافة Mg3(PO4)2 تبعًا للتركيب البلوري والظروف التي يتم قياسها فيها. الشكل الأكثر شيوعًا لـ Mg3(PO4)2، tri-Mg3(PO4)2، له كثافة 2.195 جم/مل. تعد قيمة الكثافة ضرورية لتحديد كتلة Mg3(PO4)2 المطلوبة لتحقيق حجم معين في التطبيقات المختلفة.
الوزن الجزيئي لفوسفات المغنيسيوم
Mg3(PO4)2 له وزن جزيئي قدره 262.86 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية لأيونات Mg و PO43 الموجودة في المركب. الوزن الجزيئي لـ Mg3(PO4)2 مفيد في تحديد كمية Mg3(PO4)2 اللازمة في التفاعلات الكيميائية المختلفة.
هيكل فوسفات المغنيسيوم
يحتوي Mg3(PO4)2 على بنية بلورية تختلف تبعًا لطريقة التحضير وظروفه. الشكل الأكثر شيوعًا هو ثلاثي Mg3(PO4)2، الذي يحتوي على بنية بلورية مكونة من أيونات Mg+2 وأيونات PO43- مرتبة في شبكة سداسية. يؤثر التركيب البلوري على الخواص الفيزيائية والكيميائية لـ Mg3(PO4)2.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 2.195 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 262.86 جرام/مول |
| كثافة | 2,195 جم/مل |
| نقطة الانصهار | 1188 درجة مئوية |
| نقطة الغليان | يتحلل قبل نقطة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | قابل للذوبان في الأحماض |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 7.2 |
| الرقم الهيدروجيني | 8-9 (محلول 10%) |
سلامة ومخاطر فوسفات المغنيسيوم
يعتبر Mg3(PO4)2 بشكل عام آمنًا وغير سام. وهي لا تصنف على أنها مادة خطرة ولا تشكل مخاطر كبيرة على صحة الإنسان أو البيئة. ومع ذلك، فإن التعرض لفترات طويلة لتركيزات عالية من غبار Mg3(PO4)2 قد يسبب تهيج الجهاز التنفسي. تناول كميات كبيرة من Mg3(PO4)2 قد يسبب تهيج الجهاز الهضمي والغثيان. من المهم التعامل مع Mg3(PO4)2 بعناية وارتداء معدات الحماية الشخصية المناسبة عند التعامل مع كميات كبيرة من المركب. يجب تنظيف أي انسكابات أو تسربات على الفور لتجنب أي خطر الانزلاق أو السقوط.
| رموز الخطر | لا أحد |
| وصف الأمان | لا تصنف على أنها خطيرة |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2835.29.10 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | غير سامة بتركيزات طبيعية |
طرق تصنيع فوسفات المغنيسيوم
يمكن لطرق عديدة تصنيع Mg3(PO4)2، بما في ذلك الترسيب، وتفاعل أكسيد المغنسيوم مع حمض الفوسفوريك ، وتفاعل هيدروكسيد المغنسيوم مع حمض الفوسفوريك.
تتضمن عملية الترسيب إضافة ملح فوسفات قابل للذوبان، مثل Na3PO4، إلى محلول يحتوي على ملح Mg+2 قابل للذوبان، مثل MgCl2 أو كبريتات المغنيسيوم. بعد ذلك، يؤدي خلط المحلولين إلى إنتاج راسب Mg3(PO4)2 والذي يمكن جمعه وتجفيفه.
يتضمن التفاعل إضافة أكسيد المغنيسيوم إلى محلول حمض الفوسفوريك وتسخين الخليط حتى يكتمل التفاعل. تقوم العملية بعد ذلك بجمع وغسل Mg3(PO4)2 الناتج لإزالة أي شوائب.
يتضمن التفاعل إضافة هيدروكسيد المغنيسيوم إلى محلول حمض الفوسفوريك وتسخين الخليط حتى يكتمل. ثم اجمع Mg3(PO4)2 الناتج واغسله جيدًا لإزالة كافة الشوائب.
اعتمادًا على جودة المواد الخام وظروف التفاعل، يمكن استخدام هذه الطرق لإنتاج Mg3(PO4)2 بدرجات متفاوتة من النقاء.
استخدامات فوسفات المغنيسيوم
Mg3(PO4)2 له عدة استخدامات في مختلف الصناعات، بما في ذلك:
- صناعة الأغذية: يستخدم كمضاف غذائي لتنظيم مستويات الحموضة وتحسين نسيج وجودة المخبوزات ومنتجات الألبان والمشروبات.
- الزراعة: يستخدم كسماد لتزويد النباتات بالعناصر الغذائية الأساسية مثل المغنيسيوم والفوسفور.
- صناعة الأدوية: يستخدم كعنصر نشط في مضادات الحموضة والملينات للمساعدة في تخفيف أعراض عسر الهضم والإمساك.
- معالجة المياه: يستخدم كمادة كيميائية لمعالجة المياه للتحكم في تكوين الترسبات الكلسية في الغلايات والأنابيب ولمنع التآكل.
- صناعة السيراميك: يستخدم كمادة رابطة للسيراميك لتحسين قوة ومتانة منتجات السيراميك.
- مثبط الحريق: يستخدم كمثبط للهب في مواد البناء مثل العزل والجدران الجافة والجوانب.
- مستحضرات التجميل: يستخدم في مستحضرات التجميل ومنتجات العناية الشخصية كمكثف ومستحلب.
أسئلة:
س: ما الصيغة الصحيحة للمركب المتكون بين أيونات Mg+2 وPO43-؟
ج: الصيغة الصحيحة للمركب المتكون بين أيونات Mg+2 وأيونات PO43 هي Mg3(PO4)2.
س: ما هي صيغة فوسفات المغنيسيوم؟
ج: صيغة فوسفات المغنيسيوم هي Mg3(PO4)2.
س: ما عدد الأيونات التي تشكل وحدة صيغة واحدة من فوسفات المغنيسيوم؟
ج: تحتوي وحدة الصيغة الواحدة من Mg3(PO4)2 على 11 أيونًا: ثلاثة أيونات Mg+2 واثنين من أيونات PO43-.
س: هل فوسفات المغنيسيوم قابل للذوبان؟
ج: يتمتع Mg3(PO4)2 بقابلية ذوبان منخفضة في الماء، حيث تبلغ قابلية ذوبانه حوالي 0.1 جم/100 مل في درجة حرارة الغرفة.
س: يتفاعل الحمض (x) مع القاعدة (y) لينتج Mg3(PO4)2. ما هي x و y؟
ج: الحمض (x) هو حمض الفوسفوريك (H3PO4) والقاعدة (y) هي هيدروكسيد المغنيسيوم (Mg(OH)2).
س: ما هي الكتلة المولية لـ Mg3(PO4)2، وهي مادة كانت تستخدم طبيًا كمضاد للحموضة؟
ج: الكتلة المولية لـ Mg3(PO4)2 هي 262.86 جم/مول.
س: هل المغنيسيوم 3 (PO4) 2 قابل للذوبان في الماء؟
ج: يتمتع Mg3(PO4)2 بقابلية ذوبان منخفضة في الماء، حيث تبلغ قابلية ذوبانه حوالي 0.1 جم/100 مل في درجة حرارة الغرفة.
س: ما عدد مولات ذرات الأكسجين الموجودة في مول واحد من Mg3(PO4)2؟
ج: يحتوي المول الواحد من Mg3(PO4)2 على 8 مولات من ذرات الأكسجين.
