فلوريد الصوديوم (NaF) هو مركب كيميائي يستخدم لمنع تسوس الأسنان. فهو يقوي مينا الأسنان عن طريق إعادة تمعدنها ويمنع نمو البكتيريا الضارة بالفم.
| اسم الأيوباك | فلوريد الصوديوم |
| الصيغة الجزيئية | ناف |
| CAS رقم | 7681-49-4 |
| المرادفات | أحادي فلوريد الصوديوم، فلوريد الصوديوم اللامائي، فلوريد أحادي الصوديوم، فلوريد الصوديوم، |
| سولوتيا SFL، فلوكا 01178، 3M ESPE 12104، بوريس. فلوريد الصوديوم، فلوريد الصوديوم النقي | |
| إنتشي | InChI=1S/FH.Na/h1H;/q;+1/p-1 |
خصائص فلوريد الصوديوم
صيغة فلوريد الصوديوم
الصيغة الكيميائية لفلوريد الصوديوم هي NaF. وهذا يعني أن كل جزيء NaF يتكون من أيون Na+ واحد وأيون F- واحد. الصيغة مهمة في الكيمياء لأنها توفر معلومات حول أنواع وعدد الذرات أو الأيونات الموجودة في جزيء المادة.
فلوريد الصوديوم الكتلة المولية
الكتلة المولية لـ NaF هي 41.99 جم/مول. وهو مجموع الكتلتين الذريتين لذرة الصوديوم وذرة الفلور، وهما 22.99 جم/مول و19.00 جم/مول على التوالي. الكتلة المولية هي خاصية مهمة في الكيمياء لأنها تسمح لك بحساب عدد مولات المادة بناءً على كتلتها، والعكس صحيح.
نقطة غليان فلوريد الصوديوم
نقطة غليان NaF هي 1705 درجة مئوية (3101 درجة فهرنهايت). هذه هي درجة الحرارة التي يتغير عندها الشكل السائل لـ NaF إلى شكله الغازي. يتمتع NaF بنقطة غليان عالية نسبيًا مقارنة بمركبات F الأخرى نظرًا لترابطه الأيوني القوي بين أيونات Na+ وأيونات F-.
نقطة انصهار فلوريد الصوديوم
نقطة انصهار NaF هي 993 درجة مئوية (1819 درجة فهرنهايت). هذه هي درجة الحرارة التي يتغير عندها الشكل الصلب لـ NaF إلى شكله السائل. يتمتع NaF بنقطة انصهار عالية نسبيًا بسبب الرابطة الأيونية القوية بين أيونات Na+ وأيونات F-.
كثافة فلوريد الصوديوم جم/مل
كثافة NaF هي 2.79 جم/مل. وهذا يعني أن الملليلتر الواحد من NaF يزن 2.79 جرامًا. تعد الكثافة خاصية مهمة للمادة لأنه يمكن استخدامها لتحديد كتلة المادة بناءً على حجمها، أو حجم المادة بناءً على كتلتها.
الوزن الجزيئي لفلوريد الصوديوم
الوزن الجزيئي لـ NaF هو 41.99 جم / مول. وهو مجموع الأوزان الذرية للصوديوم والفلور في جزيء NaF. الوزن الجزيئي مهم في الكيمياء لأنه يساعد في حساب الخصائص المختلفة للمادة، مثل كثافتها والمولارية.
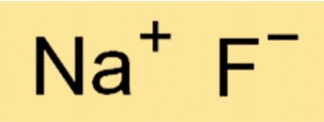
هيكل فلوريد الصوديوم
NaF له بنية بلورية في شكله الصلب. وتتكون من أيونات Na+ وأيونات F- مرتبة في هيكل شبكي مكعب. تشغل أيونات Na+ زوايا المكعب، بينما تشغل أيونات الفلورايد مراكز وجوه المكعب. وينتج عن هذا الترتيب رابطة أيونية قوية بين أيونات Na+ وأيونات F-.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.79 جم/سم3 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 41.99 جرام/مول |
| كثافة | 2.79 جرام/مل |
| نقطة الانصهار | 993 درجة مئوية (1819 درجة فهرنهايت) |
| نقطة الغليان | 1705 درجة مئوية (3101 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 4.24 جم/100 مل (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الكحول والأثير |
| ضغط البخار | 1 ملم زئبق (713 درجة مئوية) |
| كثافة بخار | 2.9 (الهواء = 1) |
| pKa | 7.2 |
| الرقم الهيدروجيني | 7.6-8.4 (0.1 م محلول مائي) |
سلامة ومخاطر فلوريد الصوديوم
لدى NaF بعض مشكلات السلامة والخطر. وهو سام إذا تم تناوله بكميات كبيرة ويمكن أن يسبب الغثيان والقيء والإسهال وآلام في البطن. قد يؤدي استنشاق غبار NaF إلى تهيج الجهاز التنفسي وتلف الرئة. قد يسبب أيضًا تهيج العين والجلد عند ملامسته. كما أن NaF يسبب تآكل بعض المعادن ويمكن أن يتفاعل بعنف مع الأحماض القوية. ينبغي اتباع إجراءات المناولة والتخزين والتخلص المناسبة عند العمل مع NaF لتجنب هذه المخاطر. من المهم دائمًا ارتداء معدات الحماية الشخصية المناسبة عند التعامل مع NaF.
| رموز الخطر | تي، ن |
| وصف الأمان | تجنب الابتلاع والاستنشاق وملامسة الجلد والعينين. ارتداء معدات الوقاية الشخصية المناسبة. اتبع إجراءات المناولة والتخزين والتخلص الآمن. |
| أرقام تعريف الأمم المتحدة | UN1690 (للصلبة) |
| رمز النظام المنسق | 2826.12.00 |
| فئة الخطر | 6.1 (المواد السامة) |
| مجموعة التعبئة | ثانيا |
| تسمم | سام إذا تم ابتلاعه أو استنشاقه بكميات كبيرة. قد يسبب تهيجًا في الجهاز التنفسي والعينين والجلد. تآكل لبعض المعادن. |
طرق تصنيع فلوريد الصوديوم
يستخدم الكيميائيون عدة طرق لتصنيع فلوريد الصوديوم (NaF).
إحدى الطرق الشائعة هي تفاعل حمض الهيدروفلوريك مع هيدروكسيد الصوديوم أو كربونات الصوديوم . لإزالة أي ماء أو شوائب، يقوم شخص ما بتجفيف المنتج الناتج وتسخينه.
تتضمن الطريقة الأخرى تفاعل “NaCl” مع “HF” ، الذي ينتج “NaF” وكلوريد الهيدروجين كمنتجات ثانوية. هذه الطريقة أقل شيوعًا بسبب مخاوف السلامة المرتبطة بالتعامل مع فلوريد الهيدروجين.
هناك طريقة أخرى لتصنيع NaF وهي تفاعل كربونات الصوديوم مع غاز HF . ينتج التفاعل NaF وثاني أكسيد الكربون وبخار الماء. تستخدم التطبيقات الصناعية عادةً هذه الطريقة لإنتاج NaF.
بالإضافة إلى ذلك، يمكن تصنيع NaF عن طريق تسخين غاز الفلور مع الصوديوم المعدني. ومع ذلك، هذه الطريقة نادرة بسبب التفاعل العالي للصوديوم والفلور. بالإضافة إلى ذلك، تتطلب هذه الطريقة معدات متخصصة ومعالجة دقيقة بسبب خطر الانفجار.
استخدامات فلوريد الصوديوم
NaF له عدة استخدامات في قطاعات مختلفة. فيما يلي بعض الاستخدامات الشائعة لـ NaF:
- نظافة الأسنان: يضيف معجون الأسنان وغسول الفم وعلاجات الأسنان NaF لمنع تسوس الأسنان وتحسين صحة الفم.
- معالجة الماء: يضاف إلى ماء الشرب في بعض المناطق لمنع تسوس الأسنان.
- التطبيقات الصناعية: يستخدم كتدفق في إنتاج الألومنيوم وفي إنتاج الزجاج والسيراميك لخفض درجة الانصهار وتحسين الشفافية.
- علم المعادن: يستخدم في تكرير ومعالجة المعادن، على سبيل المثال لإزالة الشوائب في إنتاج الفولاذ والألمنيوم.
- المبيد: يستخدم كمبيد في مكافحة القوارض والحشرات.
- الكيمياء: يستخدم كمصدر لأيونات الفلورايد في التفاعلات الكيميائية المختلفة.
- الصناعة النووية: يستخدم كمبرد ونقل للحرارة في بعض المفاعلات النووية.
- الأدوية: تستخدم في صناعة بعض الأدوية، مثل مضادات الاكتئاب، ومضادات الالتهاب.
أسئلة:
س: هل فلوريد الصوديوم الموجود في معجون الأسنان سيء لصحتك؟
ج: يعتبر NaF الموجود في معجون الأسنان آمنًا بشكل عام عند استخدامه وفقًا للتعليمات. يساعد على منع تسوس الأسنان وهو معتمد من قبل جمعيات طب الأسنان حول العالم. ومع ذلك، فإن الإفراط في تناول معجون الأسنان يمكن أن يؤدي إلى اضطراب في المعدة ومشاكل صحية أخرى.
س: هل المحلول المخفف أو المركز من فلوريد الصوديوم له نقطة غليان أعلى؟
ج: المحلول المركز من NaF سيكون له نقطة غليان أعلى من المحلول المخفف بسبب زيادة عدد جزيئات المذاب في المحلول، مما يزيد من درجة الغليان من خلال تأثير رفع نقطة الغليان.
س: كم جرام يوجد في 4.5 مول من فلوريد الصوديوم؟
ج: الكتلة المولية لـ NaF هي 41.99 جم/مول، لذا فإن 4.5 مول من NaF يساوي 188.96 جرام.
س: هل فلوريد الصوديوم أيوني أم تساهمي؟
ج: NaF هو مركب أيوني، يتكون من التجاذب الكهروستاتيكي بين أيون Na+ وأيون F-.
س: ما هي الطريقة الصحيحة لتمثيل المركب الأيوني فلوريد الصوديوم؟
ج: الطريقة الصحيحة لتمثيل هذا المركب الأيوني هي NaF، حيث يمثل Na Na+ وF يمثل F-.
س: ما اسم المركب الذي صيغته NaF؟
ج: اسم المركب الذي صيغته NaF هو فلوريد الصوديوم.
س: هل NaF حمض أم قاعدة؟
ج: NaF عبارة عن ملح يتكون من تفاعل التعادل بين قاعدة قوية (هيدروكسيد الصوديوم) وحمض ضعيف (حمض الهيدروفلوريك). وهو ليس حمضًا ولا قاعدة، ولكنه يمكن أن يخضع للتحلل المائي لتكوين محلول أساسي.
