فلوريد البوتاسيوم (KF) هو مركب كيميائي يتكون من أيونات K+ وF-. يتم استخدامه في التطبيقات الصناعية المختلفة مثل إنتاج الألومنيوم ومنتجات طب الأسنان.
| اسم الأيوباك | فلوريد البوتاسيوم |
| الصيغة الجزيئية | ك.ف. |
| CAS رقم | 7789-23-3 |
| المرادفات | أحادي فلوريد البوتاسيوم، فلوريد البوتاسيوم، فلوريد البوتاسيوم، UN 1812، EINECS 232-151-5 |
| إنتشي | InChI=1S/FH.K/h1H;/q;+1/p-1 |
خصائص فلوريد البوتاسيوم
صيغة فلوريد البوتاسيوم
الصيغة الكيميائية لفلوريد البوتاسيوم هي KF، مما يشير إلى أن أيون بوتاسيوم واحد وأيون فلوريد واحد يتحدان لتكوين وحدة صيغة واحدة للمركب. تعتبر صيغة فلوريد البوتاسيوم مفيدة لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تنطوي على المركب، وكذلك لتحديد العناصر الموجودة في عينة معينة.
فلوريد البوتاسيوم الكتلة المولية
KF لديه كتلة مولية تبلغ 58.10 جم / مول. وهو مركب يتكون من أيونات K+ وF-، مع أيون بوتاسيوم واحد وأيون فلوريد واحد لكل وحدة صيغة. الكتلة المولية هي مجموع الكتل الذرية للعناصر الموجودة في المركب، وهي في هذه الحالة 39.10 جم/مول للبوتاسيوم و19.00 جم/مول للفلور. معرفة الكتلة المولية لـ KF مفيدة لتحديد كمية المركب الموجود في عينة معينة، وكذلك لحساب العلاقات المتكافئة في التفاعلات الكيميائية.
نقطة غليان فلوريد البوتاسيوم
KF لديه نقطة غليان عالية تبلغ 1503 درجة مئوية (2737 درجة فهرنهايت). ويرجع ذلك إلى الرابطة الأيونية القوية بين أيونات K+ وF-، والتي تتطلب كمية كبيرة من الطاقة لكسرها والسماح للمركب بالدخول إلى الطور الغازي. نقطة غليان KF تجعله مفيدًا في تطبيقات درجات الحرارة المرتفعة، كما هو الحال في إنتاج الألومنيوم، حيث يتم استخدامه كتدفق لإزالة الشوائب من المعدن.
نقطة انصهار فلوريد البوتاسيوم
لدى KF نقطة انصهار منخفضة نسبيًا تبلغ 858 درجة مئوية (1576 درجة فهرنهايت). ويرجع ذلك أيضًا إلى الطبيعة الأيونية للمركب، حيث يضعف التجاذب القوي بين الأيونات الموجبة والسالبة بزيادة درجة الحرارة، مما يسمح للمركب بدخول الطور السائل. نقطة الانصهار المنخفضة لـ KF تجعله مفيدًا في العديد من التطبيقات، مثل صناعة الزجاج والسيراميك.
كثافة فلوريد البوتاسيوم جم/مل
تبلغ كثافة KF 2.48 جم / مل عند درجة حرارة الغرفة. تتأثر هذه القيمة بالتركيب البلوري المدمج للمركب بالإضافة إلى الكتلة العالية نسبيًا لأيونات K+ وF-. تعد كثافة KF مفيدة لتحديد الحجم الذي تشغله كتلة معينة من المركب، بالإضافة إلى التنبؤ بسلوكه في بيئات مختلفة.
الوزن الجزيئي لفلوريد البوتاسيوم
الوزن الجزيئي لـ KF هو 58.10 جم / مول. يتم تحديد هذه القيمة عن طريق إضافة الأوزان الذرية لأيونات K+ وF- في وحدة صيغة المركب. يعد الوزن الجزيئي لـ KF مهمًا لتحديد خواصه الفيزيائية والكيميائية، وكذلك لحساب العلاقات المتكافئة في التفاعلات الكيميائية.
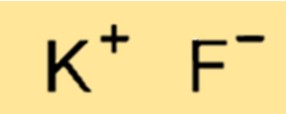
هيكل فلوريد البوتاسيوم
يحتوي KF على بنية بلورية تتكون من أيونات K+ وF- بالتناوب. يتم ربط الأيونات معًا بواسطة روابط أيونية قوية، مما يؤدي إلى بنية مستقرة وصلبة للغاية. يعد هيكل KF مهمًا لتحديد خواصه الفيزيائية والكيميائية، بالإضافة إلى التنبؤ بسلوكه في التطبيقات المختلفة.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.48 عند 20 درجة مئوية |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 58.10 جرام/مول |
| كثافة | 2.48 جم/مل عند 20 درجة مئوية |
| نقطة الانصهار | 858 درجة مئوية |
| نقطة الغليان | 1503 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 92.5 جم/100 مل عند 25 درجة مئوية |
| الذوبان | قابل للذوبان في الكحول، غير قابل للذوبان في الأثير |
| ضغط البخار | 1 ملم زئبق عند 737 درجة مئوية |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 7.3 |
| الرقم الهيدروجيني | 7 (محايد) |
سلامة ومخاطر فلوريد البوتاسيوم
يمكن أن يكون KF خطيرًا إذا لم يتم التعامل معه بشكل صحيح. وهو شديد التآكل ويمكن أن يسبب حروقًا شديدة في الجلد والعينين والجهاز التنفسي عند ملامسته. استنشاق غبار أو بخار KF قد يهيج الجهاز التنفسي ويسبب السعال وضيق التنفس. التعرض طويل الأمد لـ KF يمكن أن يسبب تلفًا مزمنًا في الرئة وتسمم الهيكل العظمي بالفلور. ومن المهم استخدام معدات الحماية، مثل القفازات والنظارات الواقية، عند التعامل مع KF، وتجنب استنشاق غباره أو أبخرته. في حالة التعرض لها، يجب طلب العناية الطبية الفورية.
| رموز الخطر | الجمجمة والعظمتين المتقاطعتين، قابلة للتآكل |
| وصف الأمان | المتجر مغلق وبعيداً عن متناول الأطفال. لا تتنفس الغبار. ارتداء الملابس الواقية المناسبة والقفازات وحماية العين / الوجه. في حالة ملامسة العينين، اغسلها فورًا بكمية كبيرة من الماء واشطفها بالطبيب. في حالة وقوع حادث أو إذا شعرت بالتوعك، اطلب العناية الطبية على الفور (أظهر الملصق إن أمكن). |
| أرقام تعريف الأمم المتحدة | UN1812 |
| رمز النظام المنسق | 2826.12.00 |
| فئة الخطر | 6.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | سام جدا؛ عن طريق الفم LD50 (الفئران) 52 ملغم / كغم |
طرق تصنيع فلوريد البوتاسيوم
هناك عدة طرق يمكن تجميعها KF. الطريقة الشائعة هي تفاعل حمض الهيدروفلوريك (HF) مع هيدروكسيد البوتاسيوم (KOH) . وينتج التفاعل KF والماء، على النحو التالي:
HF + كوه → KF + H2O
طريقة أخرى هي التفاعل بين كربونات البوتاسيوم (K2CO3) وحمض الهيدروفلوريك . وينتج التفاعل KF، والماء، وثاني أكسيد الكربون، على النحو التالي:
2HF + K2CO3 → 2KF + CO2 + H2O
عند درجات الحرارة المرتفعة، ينتج عن التفاعل بين غاز فلوريد الهيدروجين (HF) وكلوريد البوتاسيوم (KCl) غاز KF وغاز كلوريد الهيدروجين (HCl).
بوكل + HF → KF + حمض الهيدروكلوريك
تتطلب الطرق المذكورة أعلاه الحذر لأن حمض الهيدروفلوريك أو فلوريد الهيدروجين شديد التآكل والسامة.
استخدامات فلوريد البوتاسيوم
لفلوريد البوتاسيوم عدة استخدامات في صناعات مختلفة. وهذه بعض استخداماته:
- كتدفق في علم المعادن: يستخدم كتدفق في إنتاج الألومنيوم والمعادن الأخرى. يساعد على إزالة الشوائب من المعدن وتحسين جودته.
- في إنتاج مواد كيميائية أخرى: يستخدم في إنتاج عدة مواد كيميائية أخرى، مثل الكريوليت وفلوريد الألومنيوم.
- في إنتاج الزجاج: يضاف إلى الزجاج لخفض درجة انصهاره وتحسين متانته وخصائصه البصرية.
- في إنتاج المبيدات: يستخدم في إنتاج بعض المبيدات كمثبت ومحفز.
- في إنتاج معجون الأسنان: يضاف إلى معجون الأسنان كمكمل للفلورايد لمنع تسوس الأسنان.
- في المفاعلات النووية: يستخدم في المفاعلات النووية كمبرد ولمنع تآكل مكونات المفاعل.
- في الكيمياء التحليلية: يستخدم في الكيمياء التحليلية لتحديد تركيز عناصر معينة في العينة.
أسئلة:
س: ما هو KF في الكيمياء؟
ج: KF هي الصيغة الكيميائية لفلوريد البوتاسيوم. وهو مركب غير عضوي يتكون من أيون البوتاسيوم وأيون الفلورايد.
س: هل KF حمض أم قاعدة؟
ج: KF هو ملح ليس بحمض ولا بقاعدة. ومع ذلك، يمكن أن يخضع للتحلل المائي في الماء لإنتاج محلول أساسي.
س: هل فلوريد البوتاسيوم موصل للكهرباء؟
ج: KF هو مركب أيوني يمكنه توصيل الكهرباء عند إذابته في الماء أو صهره. في الواقع، يمكن للأيونات أن تتحرك بحرية وتحمل شحنة كهربائية.
س: ما هي صيغة فلوريد البوتاسيوم؟
ج: صيغة فلوريد البوتاسيوم هي KF. يتكون المركب من أيون K+ وأيون F-.
