زنكات الصوديوم مركب كيميائي له الصيغة Na2Zn(OH)4. وهو مسحوق صلب أبيض يستخدم كمقدمة في تصنيع جزيئات أكسيد الزنك النانوية وككاشف في الكيمياء العضوية.
| اسم الأيوباك | زنكات الصوديوم |
| الصيغة الجزيئية | Na2Zn(OH)4 |
| CAS رقم | 12179-14-5 |
| المرادفات | هيدروكسيد الزنك الصوديوم، زنكات الصوديوم، رباعي هيدروكسيزينات الصوديوم، الزنك، رباعي هيدروكسيد |
| إنتشي | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
صيغة زنكات الصوديوم
الصيغة الكيميائية لزنكات الصوديوم هي Na2Zn(OH)4، مما يشير إلى أنه يحتوي على أيوني صوديوم (Na+) وأيون أكسيد الزنك (ZnO2-). تُستخدم الصيغة لتمثيل تركيبة المركب ويمكن استخدامها لحساب الكتلة المولية والوزن الجزيئي وخصائص المركب الأخرى. يمكن أيضًا استخدام الصيغة لكتابة المعادلات الكيميائية والتنبؤ بمنتجات التفاعلات التي تتضمن زنكات الصوديوم.
الكتلة المولية لزنكات الصوديوم:
يتم حساب الكتلة المولية لزنكات الصوديوم عن طريق إضافة الكتل الذرية لجميع العناصر الموجودة في مول واحد من المركب. بالنسبة لزنكات الصوديوم (Na2Zn(OH)4)، تبلغ الكتلة المولية حوالي 179.42 جم/مول. يمكن أن تكون هذه القيمة مفيدة في تحديد كمية زنكات الصوديوم اللازمة لتحضير كمية محددة من المحلول أو في تحديد كتلة المركب في عينة معينة.
نقطة غليان زنكات الصوديوم:
Na2Zn(OH)4 مركب صلب وليس له نقطة غليان. ومع ذلك، فهو يتحلل عند درجات حرارة عالية ويمكن أن يكون للغازات الناتجة نقاط غليان اعتمادًا على تركيبها. ولذلك، فإن نقطة غليان Na2Zn(OH)4 ليست خاصية ذات صلة.
كثافة زنكات الصوديوم جم/مل:
تبلغ كثافة Na2Zn(OH)4 حوالي 2.7 جم/سم3. يمكن أن تكون هذه القيمة مفيدة لتحديد كتلة حجم معين من Na2Zn(OH)4 أو لتحديد حجم كتلة معينة من زنكات الصوديوم. تعتمد الكثافة على درجة الحرارة والضغط ويمكن أن تختلف حسب الظروف المحددة للتجربة.
الوزن الجزيئي لزنكات الصوديوم:
يتم حساب الوزن الجزيئي لـ Na2Zn(OH)4 عن طريق إضافة الأوزان الذرية لجميع الذرات الموجودة في الجزيء. يبلغ الوزن الجزيئي لزنكات الصوديوم حوالي 179.42 جم / مول. يعد الوزن الجزيئي خاصية مهمة لأنه يستخدم في الحسابات المتعلقة بكمية زنكات الصوديوم المطلوبة في التفاعل أو التركيبة.
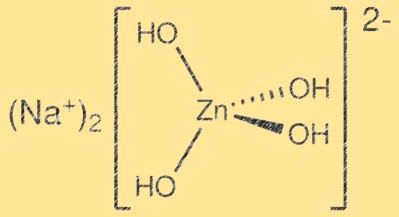
هيكل زنكات الصوديوم:
يحتوي Na2Zn(OH)4 على بنية بلورية معقدة مكونة من طبقات من رباعي الأسطح ZnO4 وNa2O6 ثماني السطوح. تتشارك رباعيات الأسطح ZnO4 في الزوايا لتشكل شبكة ثلاثية الأبعاد، بينما تشغل ثمانيات الأسطح Na2O6 المساحات الخلالية. البنية الناتجة عبارة عن طبقات ويمكن وصفها بأنها مشتقة من بنية الورتزايت. يتم تثبيت الطبقات معًا بواسطة قوى فان دير فالس ويكون الهيكل البلوري الناتج ضعيفًا نسبيًا.
| مظهر | مسحوق صلب أبيض |
| جاذبية معينة | 2.7 جرام/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 179.42 جرام/مول |
| كثافة | 2.7 جرام/سم3 |
| نقطة الانصهار | لا يوجد |
| نقطة الغليان | لا يوجد |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء، غير قابل للذوبان في المذيبات العضوية |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | القلوية (الرقم الهيدروجيني > 7) |
لاحظ أن بعض الخصائص، مثل نقطة الوميض وضغط البخار، لا علاقة لها بزنكات الصوديوم لأنه مركب صلب.
سلامة ومخاطر زنكات الصوديوم
يعرض Na2Zn(OH)4 بعض مخاطر السلامة والمخاطر التي يجب مراعاتها عند التعامل مع المركب. من المهم ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات ونظارات السلامة، عند التعامل مع Na2Zn(OH)4. قد يسبب المركب تهيج الجلد والعين، وقد يؤدي ابتلاعه إلى اضطراب الجهاز الهضمي. قد يشكل Na2Zn(OH)4 أيضًا خطر الحريق ويجب تخزينه في مكان بارد وجاف بعيدًا عن الحرارة ومصادر الاشتعال. يمكن أن تساعد المعالجة والتخزين المناسبين لـ Na2Zn(OH)4 في تقليل المخاطر المرتبطة بالمركب.
| رموز الخطر | لا أحد |
| وصف الأمان | S22: لا تتنفس الغبار. S24/25: تجنب ملامسة الجلد والعينين. S37/39: ارتداء القفازات المناسبة وحماية العين/الوجه. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2834.29 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | لم يتم تحديد السمية الدقيقة لزنكات الصوديوم بشكل جيد، ولكنها يمكن أن تسبب تهيج الجلد والعين وقد تكون ضارة إذا تم تناولها. من المهم التعامل مع المركب بعناية وارتداء معدات الحماية الشخصية المناسبة. |
طرق تصنيع زنكات الصوديوم
هناك عدة طرق يمكنك استخدامها لتصنيع Na2Zn(OH)4، لكن الطريقة الأكثر شيوعًا تتضمن خلط أكسيد الزنك وهيدروكسيد الصوديوم في محلول مائي. أولاً، تحتاج إلى خلط أكسيد الزنك مع هيدروكسيد الصوديوم في محلول مائي. ثم سخني الخليط وحركيه حتى يتشكل محلول واضح. بمجرد أن يبرد المحلول، سوف يترسب Na2Zn(OH)4 خارج المحلول، والذي يجب غسله بالماء وتجفيفه للحصول على المنتج النهائي.
هناك طريقة أخرى لتصنيع Na2Zn(OH)4 وهي إضافة الزنك إلى محلول هيدروكسيد الصوديوم وتسخين الخليط حتى يتشكل محلول واضح. بمجرد أن يبرد المحلول، سوف يترسب Na2Zn(OH)4 خارج المحلول، والذي يجب غسله بالماء وتجفيفه للحصول على المنتج النهائي.
من الضروري إجراء تخليق Na2Zn(OH)4 في منطقة جيدة التهوية وارتداء معدات الحماية الشخصية المناسبة. وينبغي أيضًا توخي الحذر عند التعامل مع هيدروكسيد الصوديوم، لأنه يمكن أن يكون مسببًا للتآكل ويسبب تهيجًا للجلد والعينين.
استخدامات زنكات الصوديوم
تستخدم الصناعات المختلفة Na2Zn(OH)4 لأغراض متعددة. أحد تطبيقاته الرئيسية هو استخدامه كمقدمة لتخليق أكسيد الزنك، الذي يستخدمه المصنعون في إنتاج المطاط والسيراميك وغيرها من المنتجات. يعمل Na2Zn(OH)4 كمثبت في إنتاج الألياف الاصطناعية والبلاستيك.
في الصناعة الزراعية، يستخدم المزارعون Na2Zn(OH)4 كسماد لتزويد النباتات بالعناصر الغذائية الأساسية مثل الزنك. ويمكنه أيضًا حماية المحاصيل من الأمراض الفطرية، حيث يعمل كمبيد للفطريات.
يستخدم مصنعو الأصباغ، مثل أصفر الزنك، Na2Zn(OH)4 في إنتاجهم، والذي يستخدم بشكل شائع في الدهانات والطلاءات. بالإضافة إلى ذلك، تستخدم الصناعات Na2Zn(OH)4 كمثبط للتآكل لحماية المعادن من التآكل.
في صناعة الأدوية، يعمل Na2Zn(OH)4 كمصدر للزنك، وهو عنصر غذائي أساسي لصحة الإنسان. يعد الزنك عنصرًا أساسيًا في العمليات البيولوجية المختلفة، ويلعب دورًا أساسيًا في الحفاظ على نظام مناعة صحي وتعزيز التئام الجروح.
بشكل عام، يحتوي Na2Zn(OH)4 على مجموعة من التطبيقات المهمة في مختلف الصناعات وهو مركب متعدد الاستخدامات وله العديد من الاستخدامات المحتملة.
أسئلة:
هل زنكات الصوديوم ملح؟
يعتبر زنكات الصوديوم ملحا لأنه يشكل مركبا أيونيا من خلال تفاعل معدن (الزنك) وقاعدة (هيدروكسيد الصوديوم). تعمل القوى الكهروستاتيكية على احتجاز أيونات الزنك الموجبة الشحنة وأيونات الصوديوم والهيدروكسيد المشحونة سالبًا معًا. الأملاح هي مركبات أيونية تتكون من التفاعل بين حمض وقاعدة أو معدن وغير معدني. على الرغم من أن Na2Zn(OH)4 لا ينتج عن تفاعل حمض وقاعدة، إلا أنه يفي بالتعريف العام للملح كمركب أيوني.
