خلات المغنيسيوم (Mg(C2H3O2)2) عبارة عن مركب يتكون من أيونات Mg2+ وC2H3O2-. يستخدم عادة كعامل تجفيف في التخليق العضوي وكمضاف غذائي.
| اسم الأيوباك | خلات المغنيسيوم |
| الصيغة الجزيئية | ملغ (C2H3O2)2 |
| CAS رقم | 142-72-3 |
| المرادفات | ثنائي أسيتات المغنيسيوم، ملح المغنيسيوم لحمض الخليك، إيثانوات المغنيسيوم، CAS 73567-85-6، EINECS 240-882-6، UNII-RS92S4G29A |
| إنتشي | InChI=1S/2C2H4O2.Mg/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
خصائص خلات المغنيسيوم
صيغة خلات المغنيسيوم
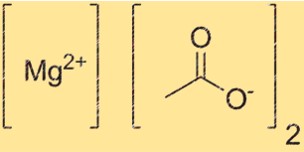
الصيغة الكيميائية لخلات المغنيسيوم هي Mg(C2H3O2)2. تمثل هذه الصيغة تركيب المركب، مع أيون Mg2+ واحد واثنين من C2H3O2-. الصيغة مهمة في تحديد كمية المركب اللازمة لتفاعل معين. ومن المفيد أيضًا تحديد المركب في سياقات مختلفة.
خلات المغنيسيوم الكتلة المولية
الكتلة المولية لـ Mg(C2H3O2)2 هي 142.39 جم/مول. يتم الحصول على هذه القيمة عن طريق إضافة الكتل الذرية لأيونات Mg2+ (24.31 جم/مول) وC2H3O2- (58.08 جم/مول). تعد الكتلة المولية خاصية مهمة في تحديد كمية Mg(C2H3O2)2 اللازمة لتفاعل معين.
نقطة غليان خلات المغنيسيوم
يحتوي Mg(C2H3O2)2 على نقطة غليان عالية نسبيًا تبلغ 117.5 درجة مئوية (243.5 درجة فهرنهايت). ترجع هذه الخاصية إلى الطبيعة الأيونية للمركب والتجاذب الكهروستاتيكي القوي بين أيونات المغنيسيوم والأسيتات. عند درجة الحرارة هذه، سيبدأ المركب في التبخر، لكنه سيبقى في حالة سائلة ما لم يتعرض لدرجات حرارة أعلى.
خلات المغنيسيوم نقطة الانصهار
نقطة انصهار Mg(C2H3O2)2 هي 160 درجة مئوية (320 درجة فهرنهايت). ويتم الحصول على هذه القيمة بتسخين المركب حتى يتحول من الحالة الصلبة إلى الحالة السائلة. تعتبر نقطة الانصهار خاصية مهمة تحدد درجة الحرارة التي يتغير عندها المركب من الحالة الصلبة إلى الحالة السائلة. هذه الخاصية ضرورية للتعامل السليم مع المجمع وتخزينه.
كثافة خلات المغنيسيوم جم / مل
كثافة Mg(C2H3O2)2 هي 1.45 جم/مل. يتم الحصول على هذه القيمة بقسمة كتلة المركب على حجمه. الكثافة هي خاصية مهمة تحدد كتلة حجم معين من المركب. كما أنها خاصية مفيدة لتحديد نقاء المركب، حيث أن الشوائب يمكن أن تؤثر على كثافته.
خلات المغنيسيوم الوزن الجزيئي
الوزن الجزيئي لـ Mg(C2H3O2)2 هو 142.39 جم/مول. يتم الحصول على هذه القيمة عن طريق إضافة الكتل الذرية للمغنيسيوم واثنين من أيونات الأسيتات. الوزن الجزيئي هو خاصية مهمة تحدد كمية المركب اللازمة لتفاعل معين. كما أنه مفيد في تحديد نقاء المركب.
هيكل خلات المغنيسيوم
يحتوي Mg(C2H3O2)2 على بنية أيونية تكون فيها كاتيونات Mg2+ محاطة باثنين من الأنيونات C2H3O2. يحتوي كاتيون Mg2+ على شحنة +2، في حين أن أنيون C2H3O2- له شحنة -1. يتم تثبيت الهيكل معًا عن طريق الجذب الكهروستاتيكي بين الأيونات المشحونة بشكل معاكس.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.45 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 142.39 جرام/مول |
| كثافة | 1.45 جم/مل |
| نقطة الانصهار | 160 درجة مئوية (320 درجة فهرنهايت) |
| نقطة الغليان | 117.5 درجة مئوية (243.5 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الإيثانول والميثانول والأسيتون |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | 4.76 |
| الرقم الهيدروجيني | 7.5 – 9.0 |
سلامة ومخاطر خلات المغنيسيوم
يعتبر Mg(C2H3O2)2 بشكل عام آمنًا للاستخدام في التطبيقات المقصودة، ولكن كما هو الحال مع أي مركب كيميائي، هناك بعض المخاطر المحتملة التي يجب الانتباه إليها. قد يهيج الجلد والعينين والجهاز التنفسي إذا تم استنشاقه أو ابتلاعه. التعرض لفترات طويلة أو متكررة قد يسبب آثارا صحية أكثر خطورة. يجب التعامل مع Mg(C2H3O2)2 بحذر ويجب اتخاذ التدابير الوقائية المناسبة عند التعامل مع هذا المركب. ومن المهم أيضًا اتباع بروتوكولات التخزين والتخلص المناسبة لتجنب التعرض العرضي أو الأضرار البيئية.
| رموز الخطر | لا أحد |
| وصف الأمان | S22 – لا تتنفس الغبار. S24/25 – تجنب ملامسة الجلد والعينين؛ S36/37/39 – ارتداء الملابس الواقية المناسبة والقفازات وأدوات حماية العين/الوجه؛ S45 – في حالة وقوع حادث أو إذا شعرت بالتوعك، استشر الطبيب على الفور (أظهر للطبيب الملصق إذا أمكن) |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 29152900 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة، ولكن يمكن أن تهيج الجلد والعينين والجهاز التنفسي إذا لم يتم التعامل معها بشكل صحيح |
طرق تصنيع خلات المغنيسيوم
يتم تصنيع Mg(C2H3O2)2 باستخدام طرق مختلفة، بما في ذلك تفاعل أكسيد المغنيسيوم أو هيدروكسيد المغنيسيوم مع حمض الأسيتيك .
في طريقة شائعة، أضف أكسيد المغنسيوم إلى محلول حمض أسيتيك لتكوين Mg(C2H3O2)2 وماء. قم بتصفية المحلول الناتج وبخره للحصول على منتج صلب Mg(C2H3O2)2.
تتضمن الطريقة الأخرى تفاعل فلز المغنيسيوم مع حمض الأسيتيك في وجود عامل محفز، مثل كلوريد النحاس أو كبريتات النحاس. ينتج عن التفاعل Mg(C2H3O2)2 وغاز الهيدروجين والنحاس المعدني كمنتج ثانوي.
يتم تصنيع Mg(C2H3O2)2 من خلال تفاعل التحويل عن طريق تفاعل كلوريد المغنيسيوم مع أسيتات الصوديوم في وجود الماء لإنتاج Mg(C2H3O2)2 وكلوريد الصوديوم.
بشكل عام، يعتمد اختيار طريقة التوليف على عوامل مثل النقاء المطلوب لمنتج Mg(C2H3O2)2، وتوافر المواد الخام، وحجم عملية الإنتاج.
استخدامات خلات المغنيسيوم
يحتوي Mg(C2H3O2)2 على مجموعة واسعة من التطبيقات في مختلف الصناعات نظرًا لخصائصه الفريدة. فيما يلي بعض الاستخدامات الشائعة لـ Mg(C2H3O2)2:
- المضافات الغذائية: تستخدم كمضافات غذائية لتحسين القيمة الغذائية للأطعمة ومنع تلفها.
- الطب: يستخدم طبياً كمصدر للمغنيسيوم، وهو معدن أساسي يلعب دوراً رئيسياً في العديد من العمليات الفسيولوجية.
- المنسوجات: تستخدم في صناعة النسيج كمادة ثابتة، وهي مادة تساعد على تثبيت الأصباغ على الأقمشة.
- معالجة المياه: تستخدم في تطبيقات معالجة المياه لإزالة الشوائب من الماء ومنع تراكم الترسبات الكلسية في الأنابيب والمعدات.
- الخرسانة: تستخدم في إنتاج الخرسانة لتحسين قوتها ومتانتها.
- التخليق الكيميائي: يستخدم كمادة خام لتخليق مركبات كيميائية أخرى، مثل الأدوية والنكهات والعطور.
أسئلة:
س: ماذا يتكون عند تفاعل حمض الأسيتيك مع كربونات المغنيسيوم؟
ج: عندما يتفاعل حمض الأسيتيك مع كربونات المغنيسيوم، Mg(C2H3O2)2، يتكون ثاني أكسيد الكربون والماء.
س: أين يمكن شراء خلات الكالسيوم والمغنيسيوم؟
ج: يمكن شراء الكالسيوم Mg(C2H3O2)2 من مختلف موردي المواد الكيميائية والأسواق عبر الإنترنت.
س: هل خلات المغنيسيوم قابلة للذوبان في الماء؟
ج: نعم، Mg(C2H3O2)2 قابل للذوبان في الماء، مع قابلية ذوبان تبلغ حوالي 54 جم / لتر في درجة حرارة الغرفة.
س: ما هو التركيز المولي لمحلول 5.00 لتر يحتوي على 0.800 مول من خلات المغنيسيوم؟
ج: التركيز المولي لمحلول سعة 5.00 L يحتوي على 0.800 مول من Mg(C2H3O2)2 هو 0.160 M.
