خلات الكالسيوم (Ca(C2H3O2)2) هو مركب يتكون من الكالسيوم وحمض الخليك. يستخدم عادة كدواء لتقليل مستويات الفوسفات لدى الأشخاص المصابين بأمراض الكلى.
| اسم الأيوباك | خلات الكالسيوم |
| الصيغة الجزيئية | كاليفورنيا (C2H3O2)2 |
| CAS رقم | 62-54-4 |
| المرادفات | حمض الخليك، ملح الكالسيوم. خلات الكالسيوم (الفرنسية)؛ ثنائي أسيتات الكالسيوم إيثانوات الكالسيوم؛ إي 263 |
| إنتشي | InChI=1S/2C2H4O2.Ca/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
خصائص خلات الكالسيوم
صيغة خلات الكالسيوم
صيغة خلات الكالسيوم هي Ca(C2H3O2)2. تشير هذه الصيغة إلى أن مول واحد من خلات الكالسيوم يحتوي على مول واحد من أيونات الكالسيوم (Ca2+) ومولين من أيونات الخلات (C2H3O2-). تعتبر صيغة خلات الكالسيوم ضرورية لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تنطوي على هذا المركب.
خلات الكالسيوم الكتلة المولية
الكتلة المولية لـ Ca(C2H3O2)2 هي 158.17 جم/مول. تمثل هذه القيمة كتلة مول واحد من Ca(C2H3O2)2، وهو ما يساوي وزنه الجزيئي. تعتبر الكتلة المولية عاملاً حاسماً في تحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تتضمن Ca(C2H3O2)2. يتم حساب هذه القيمة عن طريق جمع الكتل الذرية لجميع الذرات الموجودة في مول واحد من Ca(C2H3O2)2.
نقطة غليان خلات الكالسيوم
درجة غليان Ca(C2H3O2)2 هي 160 درجة مئوية (320 درجة فهرنهايت). تشير هذه القيمة إلى درجة الحرارة التي يغير عندها Ca(C2H3O2)2 حالته من السائل إلى الغاز. درجة غليان Ca(C2H3O2)2 أعلى بكثير من درجة غليان الماء الذي يغلي عند 100 درجة مئوية (212 درجة فهرنهايت). ترجع نقطة الغليان المرتفعة هذه إلى الطبيعة الأيونية لـ Ca(C2H3O2)2 وقوى الجزيئات القوية التي يتمتع بها.
خلات الكالسيوم نقطة الانصهار
نقطة انصهار Ca(C2H3O2)2 هي 160-170 درجة مئوية (320-338 درجة فهرنهايت). تشير هذه القيمة إلى درجة الحرارة التي يغير عندها Ca(C2H3O2)2 حالته من الصلب إلى السائل. نقطة انصهار Ca(C2H3O2)2 أعلى قليلاً من درجة انصهار الماء، الذي ينصهر عند درجة حرارة 0 درجة مئوية (32 درجة فهرنهايت). ترجع نقطة الانصهار العالية لـ Ca(C2H3O2)2 إلى الطبيعة الأيونية للمركب وقوى الجزيئات القوية.
كثافة خلات الكالسيوم جم/مل
كثافة Ca(C2H3O2)2 هي 1.5 جم/مل. تشير هذه القيمة إلى كتلة Ca(C2H3O2)2 الموجودة في مليلتر واحد من محلولها. كثافة Ca(C2H3O2)2 أكبر من كثافة الماء الذي تبلغ كثافته 1 جم/مل. تعود الكثافة العالية لـ Ca(C2H3O2)2 إلى طبيعته الأيونية ووجود أيونات الكالسيوم في المركب.
خلات الكالسيوم الوزن الجزيئي
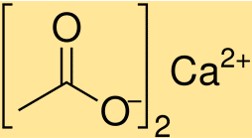
الوزن الجزيئي لـ Ca(C2H3O2)2 هو 158.17 جم/مول. تمثل هذه القيمة مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء Ca(C2H3O2)2. الوزن الجزيئي هو عامل حاسم في تحديد خصائص Ca(C2H3O2)2 وسلوكه في التفاعلات الكيميائية.
هيكل خلات الكالسيوم
هيكل Ca(C2H3O2)2 هو مركب أيوني حيث تكون أيونات Ca2+ محاطة بأيونات C2H3O2-. تعمل أيونات C2H3O2- كروابط ثنائية المسننة وتشكل روابط تنسيق مع أيونات Ca2+. هيكل Ca(C2H3O2)2 بلوري وله شكل مكعب.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 1.5 جرام/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 158.17 جرام/مول |
| كثافة | 1.5 جرام/مل |
| نقطة الانصهار | 160-170 درجة مئوية (320-338 درجة فهرنهايت) |
| نقطة الغليان | 160 درجة مئوية (320 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء والإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 9.24 |
| الرقم الهيدروجيني | 7-8 (محلول 5%) |
سلامة ومخاطر خلات الكالسيوم
يعتبر Ca(C2H3O2)2 آمنًا بشكل عام عند استخدامه وفقًا للتعليمات. ومع ذلك، فإن التعرض لكميات كبيرة من Ca(C2H3O2)2 يمكن أن يؤدي إلى تهيج الجلد والعينين والجهاز التنفسي. تناول كميات كبيرة من الكالسيوم (C2H3O2)2 يمكن أن يسبب اضطراب في المعدة والقيء والإسهال. من المهم التعامل مع Ca(C2H3O2)2 بحذر وتجنب استنشاق المادة أو تناولها. قد يشكل Ca(C2H3O2)2 أيضًا خطرًا على البيئة، وخاصة الحياة المائية، ويجب التخلص منه بشكل صحيح. كما هو الحال مع جميع المواد الكيميائية، من المهم قراءة واتباع تعليمات السلامة الموجودة على الملصق واستخدام معدات الحماية المناسبة عند التعامل مع Ca(C2H3O2)2.
| رموز الخطر | لا أحد |
| وصف الأمان | تجنب الاستنشاق والابتلاع وملامسة الجلد والعينين. استخدمه في منطقة جيدة التهوية وارتداء معدات الحماية المناسبة. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 291529 |
| فئة الخطر | غير مصنفة على أنها خطرة بموجب بلاغات المخاطر الخاصة بإدارة السلامة والصحة المهنية (29 CFR 1910.1200). |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة. قد يسبب تهيج الجلد والعين. تناول كميات كبيرة قد يسبب اضطراب في الجهاز الهضمي. |
طرق تصنيع خلات الكالسيوم
يمكن استخدام طرق مختلفة لتركيب Ca(C2H3O2)2.
تتضمن الطريقة الشائعة تفاعل كربونات الكالسيوم مع حمض الأسيتيك. أضف كربونات الكالسيوم إلى محلول حمض الأسيتيك ثم قم بتسخين الخليط حتى يرتد. قم بتصفية الخليط واترك المرشح ليبرد ويتبلور ليشكل Ca(C2H3O2)2.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد الكالسيوم مع حمض الأسيتيك . أضف هيدروكسيد الكالسيوم إلى محلول حمض الأسيتيك. قم بتحريك الخليط وتسخينه للحصول على محلول واضح. قم بتصفية المحلول واترك المرشح ليبرد ويتبلور ليشكل Ca(C2H3O2)2.
تتضمن الطريقة الأخرى تفاعل أكسيد الكالسيوم مع حمض الأسيتيك . أضف أكسيد الكالسيوم إلى محلول حمض الأسيتيك. قم بتحريك الخليط وتسخينه للحصول على محلول واضح. قم بتصفية المحلول واترك المرشح ليبرد ويتبلور ليشكل Ca(C2H3O2)2.
قد يعتمد اختيار طريقة التخليق على عوامل مثل المحصول المطلوب ونقاء المنتج، بالإضافة إلى التطبيق المحدد الذي سيتم استخدام Ca(C2H3O2)2 من أجله.
استخدامات خلات الكالسيوم
Ca(C2H3O2)2 له العديد من التطبيقات في مختلف المجالات. فيما يلي بعض الاستخدامات الشائعة لـ Ca(C2H3O2)2:
- المضافات الغذائية: تستخدم كمضافات غذائية، وخاصة في المخبوزات، لتحسين الملمس وإطالة العمر الافتراضي.
- التطبيقات الطبية: يستخدم كدواء لعلاج ارتفاع مستويات الفوسفات في الدم لدى المرضى الذين يعانون من مرض الكلى المزمن. وهو يعمل عن طريق الارتباط بالفوسفات الموجود في الطعام ومنع امتصاصه من قبل الجسم.
- معالجة المياه: يستخدم في معالجة المياه لتقليل مستويات الرصاص والمعادن الثقيلة الأخرى.
- الكاشف المعملي: يستخدم ككاشف في المختبرات للتفاعلات الكيميائية المختلفة.
- عامل مضاد للفطريات: يستخدم أيضًا كعامل مضاد للفطريات في علاج بعض الالتهابات الجلدية.
- معجل الخرسانة: يستخدم كمسرع للخرسانة، مما يساعد على تسريع عملية صب الخرسانة.
- مثبطات اللهب: تستخدم كمثبطات للهب في مواد مختلفة بما في ذلك البلاستيك والمنسوجات.
أسئلة:
س: هل خلات الكالسيوم حمضية أم قاعدية أم متعادلة؟
ج: Ca(C2H3O2)2 مركب أساسي.
س: هل خلات الكالسيوم قابلة للذوبان في الماء؟
ج: نعم، Ca(C2H3O2)2 قابل للذوبان في الماء.
س: كيفية صنع خلات الكالسيوم؟
ج: يمكن تحضير Ca(C2H3O2)2 بطرق مختلفة، بما في ذلك تفاعل كربونات الكالسيوم أو هيدروكسيد الكالسيوم مع حمض الأسيتيك. يتم بعد ذلك ترشيح الخليط الناتج ويُترك للمرشح ليبرد ويتبلور، مكونًا Ca(C2H3O2)2.
س: أين يمكن شراء خلات الكالسيوم؟
ج: يمكن شراء Ca(C2H3O2)2 من موردي المواد الكيميائية، ومتاجر مستلزمات المختبرات، وتجار التجزئة عبر الإنترنت.
س: هل خلات الكالسيوم أيونية أم تساهمية؟
ج: Ca(C2H3O2)2 مركب أيوني يتكون من كاتيونات الكالسيوم وأنيونات الأسيتات المرتبطة معًا بروابط أيونية.
