خلات البوتاسيوم (C2H3KO2) مركب يتكون من البوتاسيوم والكربون والهيدروجين والأكسجين. ويشيع استخدامه في صناعة المواد الغذائية كمادة حافظة وكمادة مزيلة للجليد لمدارج المطارات.
| اسم الأيوباك | خلات البوتاسيوم |
| الصيغة الجزيئية | C2H3KO2 |
| CAS رقم | 127-08-2 |
| المرادفات | KAC، إيثانوات البوتاسيوم |
| إنتشي | InChI=1S/C2H4O2.K/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
خصائص خلات البوتاسيوم
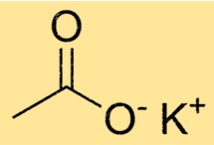
صيغة خلات البوتاسيوم
الصيغة الكيميائية لخلات البوتاسيوم هي C2H3KO2. وهو يتألف من أيون K+ وأيون CH3COO-. أيون الأسيتات متعدد الذرات، مما يعني أنه يتكون من عدة ذرات مرتبطة ببعضها البعض. وفي حالة الأسيتات، فهي تتكون من ذرتين كربون وثلاث ذرات هيدروجين وذرتين أكسجين.
خلات البوتاسيوم الكتلة المولية
يحتوي C2H3KO2 على كتلة مولية تبلغ 98.14 جم / مول. الكتلة المولية هي كتلة مول واحد من المادة ويتم حسابها عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في الجزيء. في حالة C2H3KO2، تضاف الكتل الذرية للبوتاسيوم والكربون والهيدروجين والأكسجين للوصول إلى الكتلة المولية.
نقطة غليان خلات البوتاسيوم
نقطة غليان C2H3KO2 هي 881 درجة مئوية (1618 درجة فهرنهايت). نقطة الغليان هي درجة الحرارة التي تتحول عندها المادة من سائل إلى غاز. يتمتع C2H3KO2 بنقطة غليان عالية نسبياً مقارنة بالمركبات الأخرى، ويمكن أن يعزى ذلك إلى طبيعته الأيونية والتجاذب القوي بين أيونات البوتاسيوم الموجبة الشحنة وأيونات الأسيتات سالبة الشحنة.
خلات البوتاسيوم نقطة الانصهار
نقطة انصهار C2H3KO2 هي 292 درجة مئوية (558 درجة فهرنهايت). نقطة الانصهار هي درجة الحرارة التي تتحول عندها المادة الصلبة إلى سائل. يتمتع C2H3KO2 بنقطة انصهار عالية نسبيًا، ويمكن أن يعزى ذلك إلى طبيعته الأيونية والتجاذب القوي بين أيونات البوتاسيوم الموجبة الشحنة وأيونات الأسيتات سالبة الشحنة.
كثافة خلات البوتاسيوم جم/مل
تبلغ كثافة C2H3KO2 1.57 جم / مل. الكثافة هي الكتلة لكل وحدة حجم المادة. يمكن أن تعزى الكثافة العالية نسبيًا لـ C2H3KO2 إلى طبيعته الأيونية والترتيب المدمج للأيونات في شبكته البلورية.
خلات البوتاسيوم الوزن الجزيئي
الوزن الجزيئي لـ C2H3KO2 هو 98.14 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. وفي حالة C2H3KO2، فهو مجموع الأوزان الذرية للبوتاسيوم والكربون والهيدروجين والأكسجين.
هيكل خلات البوتاسيوم
يحتوي C2H3KO2 على بنية بلورية أيونية. وهو يتألف من أيونات K+ موجبة الشحنة وأيونات CH3COO- سالبة الشحنة. يتم ترتيب أيونات الخلات في مستوى، حيث ترتبط كل ذرة كربون بذرة أكسجين وذرة هيدروجين. توجد أيونات البوتاسيوم بين مستويات أيونات الأسيتات، وتشكل شبكة بلورية ثلاثية الأبعاد.
| مظهر | مسحوق بلوري أبيض |
| كثافة محددة | 1.57 جم/سم3 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 98.14 جرام/مول |
| كثافة | 1.57 جرام/مل |
| نقطة الانصهار | 292 درجة مئوية (558 درجة فهرنهايت) |
| نقطة الغليان | 881 درجة مئوية (1618 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في الإيثانول والميثانول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 4.76 |
| الرقم الهيدروجيني | 7 (10% محلول مائي) |
سلامة ومخاطر خلات البوتاسيوم
يعتبر C2H3KO2 بشكل عام آمنًا للاستخدام البشري، مع سمية منخفضة وليس له أي آثار مسرطنة أو مطفرة معروفة. ومع ذلك، فإنه قد يسبب تهيج الجلد والعينين، كما أن التعرض لفترات طويلة أو متكررة قد يسبب التهاب الجلد. كما أنه مهيج خفيف للجهاز التنفسي وقد يسبب السعال أو ضيق التنفس إذا تم استنشاقه بكميات كبيرة. عند تناوله يمكن أن يسبب تهيج الجهاز الهضمي والغثيان والقيء. بالإضافة إلى ذلك، يمكن أن يتفاعل C2H3KO2 مع مواد كيميائية معينة لإنتاج منتجات ثانوية خطيرة، مثل حمض الأسيتيك أو هيدروكسيد البوتاسيوم. ولذلك يجب التعامل معه بعناية وتخزينه بشكل مناسب لتجنب ملامسته للمواد غير المتوافقة.
| رموز الخطر | لا أحد |
| وصف الأمان | الابتعاد عن الحرارة، والشرر واللهب. تجنب الابتلاع والاستنشاق وملامسة الجلد والعينين. ارتداء القفازات والنظارات الواقية. |
| معرف | UN2923 |
| رمز النظام المنسق | 2915.29.10 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | سمية منخفضة. قد يهيج الجلد والعينين والجهاز التنفسي. قد يسبب تناول الدواء تهيج الجهاز الهضمي والغثيان والقيء. |
طرق تصنيع خلات البوتاسيوم
لتصنيع C2H3KO2، يجب على الشخص تحييد هيدروكسيد البوتاسيوم مع حمض الأسيتيك ، أو تفاعل كربونات البوتاسيوم مع حمض الأسيتيك، أو تفاعل فلز البوتاسيوم مع حمض الأسيتيك.
في طريقة التعادل، يضاف حمض الأسيتيك ببطء إلى محلول هيدروكسيد البوتاسيوم حتى يصل الرقم الهيدروجيني إلى مستوى محايد. تؤدي هذه العملية إلى تكوين C2H3KO2 والماء. ثم يقوم المجرب بتبخير المحلول الناتج ويحصل على مادة صلبة بلورية بيضاء من C2H3KO2.
في هذه الطريقة، تتطلب العملية التسخين الكامل لخليط من حمض الأسيتيك وكربونات البوتاسيوم . بعد ذلك، يصفى الخليط لإزالة المواد الصلبة المتبقية، ثم يتبخر ويتبلور للحصول على C2H3KO2.
يعد تفاعل معدن البوتاسيوم مع حمض الأسيتيك طريقة أخرى لتصنيع C2H3KO2. تتضمن العملية إضافة البوتاسيوم المعدني إلى محلول حمض الأسيتيك، الذي ينتج C2H3KO2 وغاز الهيدروجين. ومن ثم، فإن تبخير المحلول وبلورة C2H3KO2 يسمح باستخلاصه.
استخدامات خلات البوتاسيوم
لدى C2H3KO2 مجموعة واسعة من الاستخدامات في مختلف الصناعات، بما في ذلك:
عامل إزالة الجليد: يشيع استخدامه كعامل إزالة الجليد على مدارج المطارات والجسور والأسطح الأخرى حيث يمكن لأجهزة إزالة الجليد التقليدية القائمة على الملح أن تضر بالبيئة.
مادة حافظة للأغذية: تستخدم كمادة حافظة للأغذية لمنع تلفها وإطالة مدة صلاحية بعض الأطعمة.
العامل المنظم: يستخدم كعامل منظم في العديد من الصناعات، بما في ذلك الأدوية والمنسوجات ومستحضرات التجميل.
المحفز: يستخدم كمحفز في إنتاج بعض المواد الكيميائية، مثل أنهيدريد الخل.
الكاشف المختبري: كاشف مختبري شائع لأغراض تحليلية وبحثية مختلفة.
إضافات الأعلاف الحيوانية: تستخدم كمادة مضافة للأعلاف للماشية، وخاصة في غذاء الدواجن والخنازير، لتحسين النمو والصحة العامة.
مثبطات اللهب: تستخدم كمثبطات للهب في بعض المواد البلاستيكية والمنسوجات لتقليل مخاطر الحريق.
التطبيقات الطبية: يستخدم أيضاً في بعض التطبيقات الطبية، مثل علاج نقص بوتاسيوم الدم (انخفاض مستويات البوتاسيوم) وكعنصر في بعض محاليل غسيل الكلى.
أسئلة:
س: هل خلات البوتاسيوم قابلة للذوبان؟
ج: نعم، C2H3KO2 قابل للذوبان في الماء.
س: ما هي صيغة خلات البوتاسيوم؟
ج: صيغة خلات البوتاسيوم هي CH3CO2K.
س: ما هي استخدامات خلات البوتاسيوم؟
ج: يتم استخدام C2H3KO2 لأغراض مختلفة بما في ذلك عامل إزالة الجليد، والمواد الحافظة للأغذية، وعامل التخزين المؤقت، والمحفز، والكاشف المختبري، ومضافات الأعلاف الحيوانية، ومثبطات اللهب وفي بعض التطبيقات الطبية.
س: هل خلات البوتاسيوم قابلة للذوبان في الماء؟
ج: نعم، C2H3KO2 قابل للذوبان في الماء.
س: هل خلات البوتاسيوم حمض أم قاعدة؟
ج: C2H3KO2 ليس حمضًا ولا قاعدة، ولكنه يمكن أن يعمل كعامل منظم للمساعدة في الحفاظ على درجة حموضة ثابتة في المحاليل.
