حمض النيتريك (HNO3) هو حمض غير عضوي قوي وشديد التفاعل. يتم استخدامه في الأسمدة والمتفجرات وفي صناعة صباغة المنسوجات والطباعة. كما أنه يشكل النترات، التي تلعب دورا هاما في العمليات البيولوجية وتفاعلات الاحتراق.
| اسم الأيوباك | حمض النيتريك |
| الصيغة الجزيئية | حمض الهيدروكلوريك3 |
| CAS رقم | 7697-37-2 |
| المرادفات | أكوا فورتيس، روح النترات، حمض النيتروز |
| إنتشي | إنتشي = 1S/HNO3/c2-1(3)4 |
خصائص حمض النيتريك
الكتلة المولية لحمض النيتريك
الكتلة المولية لحمض النيتريك هي 63.01 جم / مول. هي كمية المادة التي تحتوي على نفس عدد الكيانات (مثل الذرات أو الجزيئات أو الأيونات) الموجودة في 12 جرامًا من الكربون النقي 12.
صيغة حمض النيتريك
الصيغة الكيميائية لحمض النيتريك هي HNO<sub>3</sub>. وهو يمثل عدد ونوع الذرات الموجودة في الجزيء. ويمكن استخدام الصيغة للتنبؤ بخصائصه الفيزيائية والكيميائية، مثل درجة الغليان ونقطة الانصهار والكثافة.
نقطة غليان حمض النيتريك
نقطة غليان حمض النيتريك هي 83.0 درجة مئوية (181.4 درجة فهرنهايت). هي درجة الحرارة التي تتحول عندها المادة من الحالة السائلة إلى الحالة الغازية عند ضغط معين. حمض النيتريك مادة شديدة التفاعل والتطاير، وتساعد نقطة الغليان في تحديد الظروف التي يجب أن يتم التعامل معها وتخزينها فيها.
نقطة انصهار حمض النيتريك
نقطة انصهار حمض النيتريك هي -41.5 درجة مئوية (-42.7 درجة فهرنهايت). هي درجة الحرارة التي تتحول عندها المادة الصلبة إلى الحالة السائلة. نقطة الانصهار المنخفضة لحمض النيتريك تجعل من السهل التعامل معه في شكله السائل.
كثافة حمض النيتريك جم/مل
كثافة حمض النيتريك هي 1.51 جم / مل. وهو مقياس لكمية الكتلة لكل وحدة حجم من المادة. يمكن أن تساعد كثافة حمض النيتريك في تحديد متطلبات تخزينه ومناولته، بالإضافة إلى قدرته على التفاعل مع المواد الأخرى.
الوزن الجزيئي لحمض النيتريك
الوزن الجزيئي لحمض النيتريك هو 63.01 جم / مول. وهو مجموع الأوزان الذرية للذرات الفردية في الجزيء. يعد الوزن الجزيئي لحمض النيتريك عاملاً مهمًا في تحديد خواصه الفيزيائية والكيميائية.
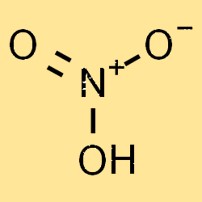
هيكل حمض النيتريك
حمض النيتريك هو سائل عديم اللون، شديد التفاعل ومتطاير. يتكون تركيبه الجزيئي من ذرة نيتروجين واحدة، وذرة هيدروجين واحدة، وثلاث ذرات أكسجين، وتشكل الصيغة الكيميائية HNO3. يتم ترتيب ذرات الأكسجين في ترتيب مستو ثلاثي الزوايا حول ذرة النيتروجين.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1.51 جم/مل |
| لون | عديم اللون |
| يشم | رائحة نفاذة ونفاذة |
| الكتلة المولية | 63.01 جم/مول |
| كثافة | 1.51 جم/مل |
| نقطة الانصهار | -41.5 درجة مئوية (-42.7 درجة فهرنهايت) |
| نقطة الغليان | 83.0 درجة مئوية (181.4 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في الكحول والأثير والمذيبات القطبية الأخرى |
| ضغط البخار | يُرفع في درجة حرارة الغرفة |
| كثافة بخار | 1.48 (الهواء = 1) |
| pKa | -1.3 |
| الرقم الهيدروجيني | 1 (محلول 10%) |
ملاحظة: لا تنطبق نقطة وميض حمض النيتريك لأنه سائل. الرقم الهيدروجيني لمحلول 10٪ من حمض النيتريك هو 1، مما يدل على أنه حمض قوي. pKa هو اللوغاريتم السلبي لثابت تفكك الحمض، وهو مقياس لقوة الحمض في المحلول.
سلامة ومخاطر حمض النيتريك
حمض النيتريك هو مادة شديدة التفاعل ومسببة للتآكل ويمكن أن تسبب إصابة خطيرة أو الوفاة إذا لم يتم التعامل معها بشكل صحيح. هذا يمكن أن يسبب الحروق وتلف العين وتهيج الجهاز التنفسي. وينبغي ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع حمض النيتريك. يجب أن تكون مناطق التخزين جيدة التهوية ويجب تنظيف الانسكابات على الفور لمنع انطلاق الأبخرة السامة. في حالة ملامسة الجلد أو العينين، اغسل المنطقة المصابة بالماء لمدة 20 دقيقة على الأقل واطلب العناية الطبية على الفور.
| رموز الخطر | خطير على البيئة، مؤكسد، ضار، مهيج |
| وصف الأمان | S2 – يُحفظ بعيدًا عن متناول الأطفال. S23 – لا تتنفس الأبخرة. S24/25 – تجنب ملامسة الجلد والعينين. S26 – في حالة ملامسة العينين، اشطفهما فورًا بالكثير من الماء واستشر الطبيب. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 2031 |
| رمز النظام المنسق | 2811.90.90 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | سامة جدا عن طريق الابتلاع والاستنشاق. قد يسبب حروقًا شديدة وتلفًا للعين، بالإضافة إلى تهيج الجهاز التنفسي. |
طرق تصنيع حمض النيتريك
يمكن تصنيع حمض النيتريك بعدة طرق، منها:
- عملية أوستفالد: تتضمن هذه الطريقة أكسدة الأمونيا مع الهواء لتكوين أكسيد النيتريك، والذي يتم أكسدته بعد ذلك إلى حمض النيتريك.
- نترات التولوين: تتضمن هذه الطريقة نترات التولوين لتكوين نيترو تولوين، والذي يتم أكسدته بعد ذلك لتكوين حمض النيتريك.
- التحلل الحراري لنترات الأمونيوم: تتضمن هذه الطريقة تسخين نترات الأمونيوم لإنتاج أكسيد النيتريك، والذي يتم بعد ذلك أكسدته لتكوين حمض النيتريك.
- الأكسدة المباشرة للأمونيا : تتضمن هذه الطريقة الأكسدة المباشرة للأمونيا مع الأكسجين لإنتاج حمض النيتريك.
- التحليل الكهربائي لنترات الصوديوم: تتضمن هذه الطريقة التحليل الكهربائي لنترات الصوديوم لإنتاج حمض النيتريك.
وتختلف هذه الطرق من حيث الفعالية والتكلفة والأثر البيئي، ويعتمد اختيار الطريقة على الاستخدام النهائي المطلوب وحجم الإنتاج.
استخدامات حمض النيتريك
لحمض النيتريك مجموعة واسعة من الاستخدامات في مختلف الصناعات، بما في ذلك:
- الأسمدة: يستخدم حمض النيتريك في إنتاج الأسمدة النيتروجينية، مثل نترات الأمونيوم وأملاح حمض النيتريك.
- المستحضرات الصيدلانية: يستخدم حمض النيتريك ككاشف في إنتاج المستحضرات الصيدلانية والوسائط الكيميائية الأخرى.
- المتفجرات: يستخدم حمض النيتريك في إنتاج المتفجرات، مثل الديناميت والنيتروسليلوز.
- معالجة المعادن: يستخدم حمض النيتريك في تخليل وتنظيف ونقش المعادن، بما في ذلك الفولاذ والنحاس والألمنيوم.
- الصباغة والطباعة: يستخدم كمادة لاصقة في عمليات الصباغة والطباعة.
- معالجة المياه: يستخدم حمض النيتريك في معالجة المياه للتحكم في مستويات الرقم الهيدروجيني وإزالة الشوائب.
- البحث والتطوير: يستخدم حمض النيتريك ككاشف مختبري لمختلف التفاعلات والتحليلات الكيميائية.
بشكل عام، يحتوي حمض النيتريك على مجموعة متنوعة من التطبيقات بسبب خصائصه الحمضية والمؤكسدة، مما يجعله مادة كيميائية حاسمة في العمليات الصناعية المختلفة.
أسئلة:
هل حمض النيتريك حمض قوي أم حمض ضعيف؟
نعم يعتبر حمض النيتريك (HNO3) من الأحماض القوية. تتفكك الأحماض القوية تمامًا في الماء لتنتج أيونات الهيدروجين (H+)، مما يعني أنها تتأين تمامًا. وعلى النقيض من ذلك، تتأين الأحماض الضعيفة جزئيًا فقط في الماء، مما يعني أنها لا تنفصل تمامًا.
في محلول حمض النيتريك، يكون كل جزيء تقريبًا قد تبرع بأيون هيدروجين، مما يجعله مانحًا قويًا للبروتونات. ونتيجة لذلك، يحتوي حمض النيتريك على تركيز عالٍ من أيونات الهيدروجين ودرجة حموضة منخفضة، عادةً حوالي 1-2. يتم تحديد قوة الحمض من خلال قدرته على التبرع بأيونات الهيدروجين ويعتبر حمض النيتريك من أقوى الأحماض في قائمة الأحماض القوية.
لاحظ أن حمض النيتريك (HNO3) له تأثير مؤكسد قوي ويشكل خطر الإصابة بحروق خطيرة وتفاعلات كيميائية. تعامل مع حمض النيتريك بعناية وارتداء معدات الحماية المناسبة.
