حمض الفوسفوريك (H3PO4) هو حمض معدني عديم اللون والرائحة. يستخدم على نطاق واسع في صناعة الأغذية والمشروبات كعامل نكهة وكمثبط للصدأ في صناعة السيارات.
| اسم الأيوباك | حمض الفسفوريك |
| الصيغة الجزيئية | H3PO4 |
| CAS رقم | 7664-38-2 |
| المرادفات | حمض الأورثوفوسفوريك، ثلاثي هيدروكسيد أوكسيد الفوسفور، حمض الفوسفوريك (V)، حمض الأورثوفوسفوريك، تكنولوجيا حمض الفوسفوريك الصافي، الفوسفورسور |
| إنتشي | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
خصائص حمض الفوسفوريك
الكتلة المولية لحمض الفوسفوريك
الكتلة المولية لحمض الفوسفوريك هي 98.00 جم / مول. ويتم حساب هذه القيمة عن طريق جمع الكتل الذرية لكل من الذرات المكونة للجزيء، وهي ذرة فوسفور واحدة وثلاث ذرات أكسجين. الكتلة المولية هي خاصية مهمة للمركب لأنها تستخدم لحساب كمية المادة الموجودة في عينة معينة باستخدام رقم أفوجادرو. بالإضافة إلى ذلك، يتم استخدام الكتلة المولية لحمض الفوسفوريك لتحديد تركيز المحلول عن طريق المعايرة.
صيغة حمض الفوسفوريك
الصيغة الكيميائية لحمض الفوسفوريك هي H3PO4، مما يدل على أنه يحتوي على ذرة واحدة فوسفور، وثلاث ذرات هيدروجين، وأربع ذرات أكسجين. وهو حمض ضعيف يمكنه التبرع بما يصل إلى ثلاثة أيونات هيدروجين للقاعدة. الصيغة مهمة لأنها تسمح لنا بكتابة المعادلات الكيميائية وحساب العناصر الكيميائية للتفاعلات الكيميائية التي تنطوي على حمض الفوسفوريك. بالإضافة إلى ذلك، يتم استخدام الصيغة لحساب تركيز محلول حمض الفوسفوريك عن طريق المعايرة.
نقطة غليان حمض الفوسفوريك
نقطة غليان حمض الفوسفوريك هي 158 درجة مئوية (316 درجة فهرنهايت) عند ضغط جوي واحد. وهذا يعني أنه عند درجة الحرارة والضغط هذه، سيتحول الطور السائل لحمض الفوسفوريك إلى الطور الغازي. تعتمد نقطة الغليان على القوى الجزيئية الموجودة في المركب، وفي حالة حمض الفوسفوريك، يرجع ذلك إلى وجود روابط هيدروجينية بين الجزيئات. تعتبر نقطة الغليان خاصية فيزيائية مهمة للمركب لأنها تستخدم لتحديد درجة تطايره، وهو أمر مفيد في العديد من العمليات الصناعية.
نقطة انصهار حمض الفوسفوريك
نقطة انصهار حمض الفوسفوريك هي 42.35 درجة مئوية (108.23 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها الطور الصلب لحمض الفوسفوريك إلى الطور السائل. تعتمد نقطة الانصهار على قوة القوى الجزيئية الموجودة في المركب، وفي حالة حمض الفوسفوريك، يرجع ذلك إلى وجود روابط هيدروجينية بين الجزيئات. تعتبر نقطة الانصهار خاصية فيزيائية مهمة للمركب لأنها تستخدم لتحديد نقائه وتحديد هويته.
كثافة حمض الفوسفوريك جم/مل
تبلغ كثافة حمض الفوسفوريك 1.685 جم / مل عند درجة حرارة الغرفة (25 درجة مئوية أو 77 درجة فهرنهايت). هذه هي كتلة المادة لكل وحدة حجم. الكثافة هي خاصية فيزيائية للمادة وتستخدم لحساب حجم كتلة معينة من المادة أو كتلة حجم معين من المادة. ولكثافة حمض الفوسفوريك أهمية في العديد من العمليات الصناعية، بما في ذلك إنتاج الأسمدة والمنظفات والمضافات الغذائية.
الوزن الجزيئي لحمض الفوسفوريك
الوزن الجزيئي لحمض الفوسفوريك هو 98.00 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. يعد الوزن الجزيئي خاصية مهمة للمركب لأنه يستخدم لحساب كمية المادة الموجودة في عينة معينة. بالإضافة إلى ذلك، يتم استخدام الوزن الجزيئي لحمض الفوسفوريك لتحديد تركيز المحلول عن طريق المعايرة.
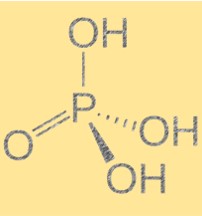
هيكل حمض الفوسفوريك (H3PO4)
يحتوي حمض الفوسفوريك على صيغة جزيئية لـ H3PO4 وهندسة جزيئية رباعية السطوح. وهو حمض ثلاثي البروتيك، مما يعني أنه يمكنه التبرع بثلاثة أيونات هيدروجين لقاعدة واحدة. يحتوي الجزيء على ذرة فوسفور مرتبطة بأربع ذرات أكسجين، ثلاث منها مرتبطة بذرات الهيدروجين. إن بنية حمض الفوسفوريك مهمة لأنها تحدد خواصه الكيميائية والفيزيائية. يؤدي وجود الروابط الهيدروجينية بين الجزيئات إلى ارتفاع درجات الغليان والانصهار.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1.685 عند 25 درجة مئوية |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 98.00 جرام/مول |
| كثافة | 1.685 جم/مل عند 25 درجة مئوية |
| نقطة الانصهار | 42.35 درجة مئوية (108.23 درجة فهرنهايت) |
| نقطة الغليان | 158 درجة مئوية (316 درجة فهرنهايت) عند ضغط 1 جو |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان تماما في الماء |
| الذوبان | قابل للذوبان في الإيثانول، ثنائي إيثيل الأثير والأسيتون |
| ضغط البخار | 0.0002 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | 3.5 (الهواء = 1) |
| pKa | pKa1=2.148، pKa2=7.198، pKa3=12.319 |
| الرقم الهيدروجيني | 1.0 – 2.5 (محلول مركز)، 2.8 – 3.2 (محلول مخفف) |
H3PO4 السلامة والمخاطر
يشكل حمض الفوسفوريك العديد من مخاطر السلامة ويجب التعامل معه بحذر. يمكن أن يسبب تهيجًا شديدًا في الجلد والعين، كما أنه يسبب تآكلًا شديدًا للمعادن. الاتصال المباشر بالجلد أو العينين أو الأغشية المخاطية يمكن أن يسبب حروقًا شديدة أو حتى ضررًا دائمًا. استنشاق الأبخرة قد يسبب تهيج الجهاز التنفسي والحروق. لا ينبغي تناوله لأنه يمكن أن يسبب حروقًا داخلية شديدة واضطرابات في الجهاز الهضمي. عند التعامل مع حمض الفوسفوريك، يجب ارتداء معدات الحماية الشخصية المناسبة مثل القفازات والنظارات الواقية وجهاز التنفس الصناعي. ويجب أيضًا تخزينه في مكان بارد وجاف بعيدًا عن المواد غير المتوافقة مثل العوامل المؤكسدة والقلويات.
| رموز الخطر | تآكل |
| وصف الأمان | الحفاظ على حاوية مغلقة بإحكام. ارتداء القفازات الواقية / الملابس الواقية / حماية العين / حماية الوجه. |
| أرقام تعريف الأمم المتحدة | UN1805 |
| رمز النظام المنسق | 280920 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | الثاني (خطر متوسط) |
| تسمم | الجرعة المميتة 50 عن طريق الفم (الفئران) – 1533 ملغم/كغم |
طرق تصنيع H3PO4
توجد عدة طرق لتصنيع حمض الفوسفوريك (H3PO4).
الطريقة الأكثر شيوعًا هي العملية الرطبة التي تتضمن تفاعل صخر الفوسفات مع حمض الكبريتيك . لإنتاج كبريتات الكالسيوم (الجبس) وH3PO4، يتم أولاً سحق صخر الفوسفات ثم خلطه مع حامض الكبريتيك المركز. بعد تصفية المعلق الناتج، تعمل سلسلة خطوات استخلاص المذيبات والترسيب على تنقية H3PO4.
هناك طريقة أخرى لتصنيع H3PO4 وهي العملية الحرارية التي تتضمن تسخين صخور الفوسفات إلى درجة حرارة عالية لإنتاج H3PO4 ومنتجات ثانوية أخرى مثل عنصر الفوسفور وأكسيد الكالسيوم. هذه الطريقة أقل شيوعًا من العملية الرطبة نظرًا لمتطلباتها العالية من الطاقة.
تفاعل خامس أكسيد الفوسفور مع الماء ينتج H3PO4. تستخدم صناعات الإلكترونيات وأشباه الموصلات عادةً هذه الطريقة لإنتاج H3PO4 عالي النقاء.
تشمل الطرق الأخرى لتصنيع H3PO4 الأكسدة الكهروكيميائية للفوسفور، والتحلل المائي لثلاثي كلوريد الفوسفور، وتفاعل الفوسفور مع حمض النيتريك . هذه الطرق أقل شيوعًا من العمليات الرطبة والحرارية بسبب تكلفتها العالية وتعقيدها.
استخدامات H3PO4
حمض الفوسفوريك هو مركب متعدد الاستخدامات وله مجموعة واسعة من التطبيقات في مختلف الصناعات. بعض استخداماته الرئيسية هي:
- إنتاج الأسمدة: المكون الرئيسي لإنتاج الأسمدة مثل فوسفات ثنائي الأمونيوم والسوبر فوسفات الثلاثي.
- صناعة الأغذية والمشروبات: تستخدم كمادة مضافة ومنكهة للأغذية في مختلف المنتجات الغذائية والمشروبات مثل مشروبات الكولا والمربيات والجبن المطبوخ.
- التنظيف الصناعي: يستخدم كمنظف ومزيل للصدأ في القطاع الصناعي نظراً لقدرته على إذابة الصدأ والرواسب المعدنية الأخرى.
- معالجة المياه: تستخدم للتحكم في مستويات الرقم الهيدروجيني للمياه في العمليات الصناعية وأيضا لإزالة المعادن الثقيلة والشوائب الأخرى.
- المستحضرات الصيدلانية: يستخدم في إنتاج المستحضرات الصيدلانية والمكملات الغذائية نظراً لقدرته على تنظيم مستويات الرقم الهيدروجيني.
- طب الأسنان: يستخدم في إجراءات طب الأسنان مثل علاج قناة الجذر وكأحد مكونات الأسمنت السني.
- معالجة المعادن: يستخدم لمعالجة وتخميل المعادن مثل الفولاذ المقاوم للصدأ والألومنيوم والتيتانيوم لتحسين مقاومتها للتآكل.
- الإلكترونيات: تستخدم في صناعة الإلكترونيات كعامل تنظيف وكعنصر في إنتاج أشباه الموصلات.
أسئلة:
س: ما هي صيغة حمض الفوسفوريك؟
ج: صيغة حمض الفوسفوريك هي H3PO4.
س: هل H3PO4 حمض قوي؟
ج: لا، لا يعتبر H3PO4 حمضًا قويًا. وهو حمض ضعيف بقيمة pKa تبلغ 2.15.
س: هل H3PO4 حمض أم قاعدة؟
ج: H3PO4 حمض لأنه يعطي بروتون (H+) عندما يذوب في الماء.
س: ما هو هيكل لويس لـ H3PO4؟
ج: إن بنية لويس لـ H3PO4 هي بنية رباعية السطوح تحتوي على ذرة فوسفور مركزية محاطة بأربع ذرات أكسجين. تشكل كل ذرة أكسجين رابطة واحدة مع ذرة الفوسفور، ويوجد أيضًا ثلاثة أزواج من الإلكترونات المنفردة في كل ذرة أكسجين.
س: هل حمض الفوسفوريك حمض قوي؟ ج: لا، حمض الفوسفوريك لا يعتبر حمضا قويا. وهو حمض ضعيف بقيمة pKa تبلغ 2.15 للتبرع بالبروتون الأول و7.20 للتبرع بالبروتون الثاني.
