ثنائي هيدرات كلوريد الباريوم هو مركب بلوري أبيض له الصيغة الكيميائية BaCl2·2H2O. ويشيع استخدامه في المختبر ككاشف وفي الصناعة لمعالجة الأسطح المعدنية.
| اسم الأيوباك | ثنائي هيدرات كلوريد الباريوم |
| الصيغة الجزيئية | BaCl2·2H2O |
| CAS رقم | 10326-27-9 |
| المرادفات | ثنائي كلوريد الباريوم ثنائي الهيدرات؛ ثنائي هيدرات كلوريد الباريوم (II)؛ كلوريد الباريوم المائي (1:2:2)؛ كلوريد الباريوم 2-هيدرات؛ ثنائي هيدرات كلوريد الباريوم؛ ثنائي كلوريد الباريوم، ثنائي الهيدرات؛ ثنائي هيدرات كلوريد الباريوم (2+). |
| إنتشي | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
BaCl2·2H2O الكتلة المولية
الكتلة المولية لثنائي هيدرات كلوريد الباريوم (BaCl2·2H2O) هي 244.26 جم/مول. يمكن حساب هذه القيمة عن طريق جمع الكتل الذرية لكل عنصر موجود في المركب. يحتوي الباريوم على كتلة مولية قدرها 137.33 جم/مول، والكلور لديه كتلة مولية قدرها 35.45 جم/مول، والهيدروجين والأكسجين لهما كتل مولية قدرها 1.01 جم/مول و16.00 جم/مول على التوالي. يضيف جزيئي الماء 36.02 جم/مول أخرى. تعتبر الكتلة المولية لـ BaCl2 · 2H2O مهمة في الحسابات المتكافئة حيث يتم التعبير عن كمية المادة المتفاعلة أو المنتج بالشامات.
صيغة ثنائي هيدرات كلوريد الباريوم
الصيغة الكيميائية لثنائي هيدرات كلوريد الباريوم هي BaCl2·2H2O. تشير هذه الصيغة إلى أن كل وحدة صيغة للمركب تحتوي على أيون باريوم واحد، وأيوني كلوريد، وجزيئين ماء. الصيغة مهمة للحسابات المتكافئة ولفهم الخواص الكيميائية والفيزيائية للمركب.
نقطة غليان ثنائي هيدرات كلوريد الباريوم
درجة غليان BaCl2·2H2O هي 1560 درجة مئوية. عند درجة الحرارة هذه، سيخضع المركب لمرحلة انتقالية من السائل إلى الغاز. ترجع نقطة الغليان العالية إلى الطبيعة الأيونية للمركب، والتي تتطلب كمية كبيرة من الطاقة لتحطيم القوى الكهروستاتيكية القوية التي تربط الأيونات معًا. يستخدم BaCl2 2H2O في الصناعة كعامل معالجة حرارية للأسطح المعدنية بسبب ارتفاع درجات انصهاره وغليانه.
نقطة انصهار ثنائي هيدرات كلوريد الباريوم
درجة انصهار BaCl2 · 2H2O هي 962 درجة مئوية. عند درجة الحرارة هذه، سيتحول المركب من الحالة الصلبة إلى الحالة السائلة. ترجع نقطة الانصهار العالية لـ BaCl2·2H2O إلى الروابط الأيونية القوية بين أيونات الباريوم والكلور، وكذلك الروابط الهيدروجينية بين جزيئات الماء. تعتبر نقطة انصهار BaCl2 · 2H2O خاصية مهمة لاستخدامها في تطبيقات مختلفة مثل إنتاج الأصباغ والأصباغ ومعالجة الأسطح المعدنية.
كثافة ثنائي هيدرات كلوريد الباريوم جم/مل
تبلغ كثافة ثنائي هيدرات كلوريد الباريوم 3.097 جم/سم3. وهذا يعني أن 1 سم مكعب من ثنائي هيدرات كلوريد الباريوم يزن 3.097 جرام. تعد كثافة المادة خاصية مهمة يمكن أن توفر نظرة ثاقبة لخصائصها الفيزيائية والكيميائية. في حالة ثنائي هيدرات كلوريد الباريوم، ترجع الكثافة العالية إلى الكتلة الذرية الكبيرة نسبيًا للباريوم والتعبئة المتقاربة للأيونات في بنية الشبكة البلورية.
BaCl2 · 2H2O الوزن الجزيئي
الوزن الجزيئي لـ BaCl2·2H2O هو 244.26 جم/مول. ويمكن حساب هذه القيمة عن طريق إضافة الأوزان الذرية لكل عنصر موجود في المركب. يعد الوزن الجزيئي خاصية مهمة لـ BaCl2 · 2H2O لأنه يستخدم في تطبيقات مختلفة مثل إنتاج الأصباغ والأصباغ، وككاشف في التجارب المعملية.
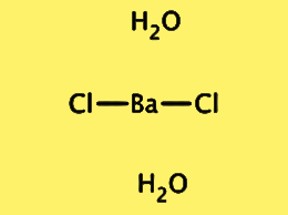
هيكل BaCl2·2H2O
التركيب البلوري لـ BaCl2·2H2O هو معيني متعامد، مع المجموعة الفضائية Pnma. تحتوي خلية الوحدة على وحدة واحدة لها الصيغة BaCl2·2H2O، وتتكون من أيون باريوم واحد، وأيونات كلوريد، وجزيئين ماء. أيون الباريوم محاط بثمانية أيونات كلوريد، وجزيئات الماء مرتبطة بالهيدروجين مع أيونات الكلوريد. يعد التركيب البلوري لـ BaCl2 · 2H2O مهمًا لفهم خصائصه الفيزيائية والكيميائية، بالإضافة إلى استخدامه في التطبيقات المختلفة.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 3.097 جم/سم3 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 244.26 جرام/مول |
| كثافة | 3.097 جم/سم3 |
| نقطة الانصهار | 962 درجة مئوية |
| نقطة الغليان | 1560 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 31.2 جم/100 مل (عند 20 درجة مئوية) |
| الذوبان | قابل للذوبان في الكحول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | محايد (7) |
ملاحظة: قد لا تتم محاذاة الجدول بشكل صحيح وفقًا لإعدادات العرض الخاصة بالنظام الأساسي أو الجهاز الذي تستخدمه.
سلامة ومخاطر ثنائي هيدرات كلوريد الباريوم
يشكل BaCl2 2H2O العديد من المخاطر على السلامة والصحة، والتي يمكن أن تكون ضارة إذا لم يتم التعامل معها بشكل صحيح. وهي مادة قابلة للتآكل يمكن أن تسبب حروقًا شديدة في الجلد والعينين عند ملامستها. استنشاق غباره أو أبخرةه يمكن أن يسبب مشاكل في الجهاز التنفسي وتلف الرئة. كما أنه سام إذا تم تناوله ويمكن أن يسبب مشاكل في الجهاز الهضمي. يجب التعامل مع BaCl2 2H2O بحذر ويجب ارتداء معدات الحماية المناسبة مثل القفازات والنظارات الواقية وأجهزة التنفس عند العمل مع المركب. يجب تخزينه بعيدًا عن المواد غير المتوافقة وفي منطقة آمنة لمنع التعرض العرضي. في حالة الطوارئ، اطلب العناية الطبية على الفور.
| رموز الخطر | تآكل (ج) | |
| وصف الأمان | ||
| معرفات | UN1564 | |
| رمز النظام المنسق | 28273990 | |
| فئة الخطر | 8 | |
| مجموعة التعبئة | ثالثا | |
| تسمم | سامة إذا ابتلع. يمكن أن يسبب مشاكل في الجهاز الهضمي. تآكل الجلد والعينين. استنشاق الغبار أو البخار قد يسبب مشاكل في الجهاز التنفسي وتلف الرئة. | |
طرق تصنيع ثنائي هيدرات كلوريد الباريوم
يمكنك تصنيع BaCl2·2H2O بعدة طرق.
الطريقة الشائعة هي تفاعل كربونات الباريوم أو هيدروكسيد الباريوم مع حمض الهيدروكلوريك. يجب عليك تبخير المحلول الناتج للحصول على المركب الصلب.
هناك طريقة أخرى وهي تفاعل كبريتيد الباريوم مع حمض الهيدروكلوريك. ينتج عن هذا التفاعل غاز كبريتيد الهيدروجين، والذي يجب عليك التخلص منه بشكل صحيح. تتم بعد ذلك تنقية المحلول الناتج عن طريق الترشيح والبلورة للحصول على المنتج النهائي.
يمكنك أيضًا تصنيع BaCl2 · 2H2O عن طريق تفاعل الترسيب باستخدام كلوريد الصوديوم ونترات الباريوم. تحتاج إلى خلط المركبين في محلول، ثم تصفية الراسب الناتج وتجفيفه للحصول على المركب الصلب.
بالإضافة إلى ذلك، يمكن تصنيع BaCl2 · 2H2O عن طريق تفاعل أكسيد الباريوم مع حمض الهيدروكلوريك. ينتج عن هذا التفاعل الماء كمنتج ثانوي، والذي يجب عليك إزالته من خلال التبخر. ثم تتم بلورة المحلول الذي تم الحصول عليه للحصول على المنتج النهائي.
عند العمل مع BaCl2 2H2O، يجب عليك اتخاذ احتياطات السلامة المناسبة لأنه مركب سام ومسبب للتآكل. يجب عليك ارتداء معدات الحماية مثل القفازات والنظارات الواقية وأجهزة التنفس، والتعامل مع المركب في منطقة جيدة التهوية.
استخدامات ثنائي هيدرات كلوريد الباريوم
BaCl2 2H2O له استخدامات عديدة في مختلف الصناعات.
- تستخدم الصناعة الكيميائية BaCl2 · 2H2O ككاشف في العديد من التفاعلات الكيميائية، مثل إنتاج أملاح الباريوم والأصباغ والسيراميك.
- وهو يعمل بمثابة تدفق في تكرير المعادن وكمحفز في التخليق العضوي.
- تستخدم الصناعة الطبية BaCl2 2H2O كعامل تباين في التصوير الشعاعي ولعلاج التسمم بالباريوم. كما أنها تستخدم في صناعة الأسمنت الأسنان.
- تستخدم صناعة النسيج BaCl2 2H2O كمادة لاذعة، وهي مادة تربط الأصباغ بالألياف، وكمادة مثبطة للهب في المنسوجات.
- في صناعة البترول، يتم استخدام BaCl2 2H2O كمادة مضافة لطين الحفر لزيادة كثافة الطين ومنع الانفجارات أثناء عمليات الحفر.
- تستخدم صناعة المواد الغذائية BaCl2 2H2O كمادة حافظة ومحسنة للنكهة لبعض الأطعمة.
ينبغي اتخاذ احتياطات السلامة المناسبة، مثل ارتداء معدات الحماية والتعامل مع المركب في منطقة جيدة التهوية، لتقليل المخاطر المرتبطة بالعمل مع BaCl2 2H2O المسببة للتآكل والسامة.
أسئلة:
ما هي صيغة ثنائي هيدرات كلوريد الباريوم؟
صيغة ثنائي هيدرات كلوريد الباريوم هي BaCl2·2H2O.
هل ثنائي هيدرات كلوريد الباريوم قابل للذوبان في الماء؟
نعم، ثنائي هيدرات كلوريد الباريوم قابل للذوبان بدرجة عالية في الماء. يذوب بسهولة في الماء، مع ذوبان حوالي 31.2 جم/100 مل في درجة حرارة الغرفة. هذه القابلية العالية للذوبان تجعله مركبًا مفيدًا في العديد من الصناعات، مثل إنتاج أملاح الباريوم وكمادة مضافة لطين الحفر في صناعة البترول. ومع ذلك، فإن قابليته العالية للذوبان تعني أيضًا أنه يمكن أن يشكل خطراً على صحة الإنسان والبيئة إذا لم يتم التعامل معه بشكل صحيح، لأنه يمكن أن يلوث مصادر المياه ويسبب سمية للكائنات المائية. ولذلك، ينبغي اتخاذ الاحتياطات المناسبة عند العمل مع BaCl2 · 2H2O لتجنب التلوث وضمان التعامل الآمن.
