ثنائي كبريتيت الصوديوم (NaHSO3) هو مركب كيميائي يستخدم كمادة حافظة للأغذية وفي التطبيقات الصناعية المختلفة. وهو يعمل عن طريق تثبيط نمو البكتيريا ومنع الأكسدة.
| اسم الأيوباك | كبريتات هيدروجين الصوديوم |
| الصيغة الجزيئية | NaHSO3 |
| CAS رقم | 7631-90-5 |
| المرادفات | ثنائي كبريتيت الصوديوم، كبريتيت حمض الصوديوم، كبريتيت هيدروجين الصوديوم، كبريتيت هيدروجين الصوديوم، مونوهيدرات كبريتيت الصوديوم |
| إنتشي | InChI=1S/Na.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
خصائص ثنائي كبريتيت الصوديوم
صيغة كبريتات الصوديوم
الصيغة الكيميائية لثنائي كبريتيت الصوديوم هي NaHSO3. تشير هذه الصيغة إلى عدد ونوع الذرات الموجودة في جزيء واحد من ثنائي كبريتيت الصوديوم. تعتبر الصيغة حاسمة في تحديد سلوك ثنائي كبريتيت الصوديوم في ظل تفاعلات كيميائية وظروف فيزيائية مختلفة.
الكتلة المولية لثنائي كبريتيت الصوديوم
NaHSO3 لديه كتلة مولية تبلغ 104.06 جم / مول. هذا هو مجموع الكتل الذرية للعناصر المكونة لجزيء NaHSO3 واحد. الكتلة المولية هي خاصية فيزيائية مهمة تساعد في تحديد كمية المادة في عينة معينة.
نقطة غليان ثنائي كبريتيت الصوديوم
درجة غليان NaHSO3 هي 150 درجة مئوية. هذه هي درجة الحرارة التي يبدأ عندها الشكل السائل لـ NaHSO3 بالتحول إلى غاز. نقطة الغليان هي خاصية فيزيائية حاسمة تحدد كيفية تصرف المادة في ظل ظروف درجات الحرارة المختلفة.
نقطة انصهار ثنائي كبريتيت الصوديوم
درجة انصهار NaHSO3 هي 150 درجة مئوية. هذه هي درجة الحرارة التي يبدأ عندها الشكل الصلب لـ NaHSO3 بالتحول إلى سائل. تعتبر نقطة الانصهار خاصية فيزيائية أساسية تساعد في تحديد سلوك المادة في ظل ظروف درجات الحرارة المختلفة.
كثافة ثاني كبريتيت الصوديوم جم / مل
تبلغ كثافة NaHSO3 1.48 جم/مل. يشير هذا إلى كمية الكتلة الموجودة في حجم معين من NaHSO3. تعد الكثافة خاصية فيزيائية مهمة تساعد في تحديد كيفية تصرف المادة تحت ظروف الضغط ودرجة الحرارة المختلفة.
الوزن الجزيئي كبريتيت الصوديوم
الوزن الجزيئي لـ NaHSO3 هو 104.06 جم / مول. هذا هو مجموع الأوزان الذرية للعناصر المكونة لجزيء NaHSO3 واحد. الوزن الجزيئي هو خاصية فيزيائية أساسية تساعد في تحديد كمية المادة في عينة معينة.
هيكل ثنائي كبريتيت الصوديوم
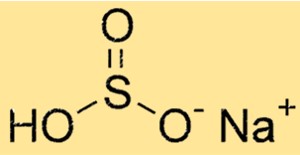
يحتوي NaHSO3 على بنية جزيئية تتكون من كاتيون الصوديوم (Na+) وأنيون HSO3-. يتكون الأنيون من ذرة كبريت واحدة وثلاث ذرات أكسجين وذرة هيدروجين واحدة. يحدد هيكل NaHSO3 خصائصه الكيميائية والفيزيائية.
ذوبان ثنائي كبريتيت الصوديوم
NaHSO3 قابل للذوبان بدرجة عالية في الماء، مع ذوبان 62 جم / 100 مل عند 20 درجة مئوية. كما أنه قابل للذوبان في الجلسرين وقابل للذوبان بشكل طفيف في الكحول. قابليته للذوبان في الماء تجعله كاشفًا مفيدًا في التفاعلات الكيميائية المختلفة.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 1.48 |
| لون | الأبيض إلى الأصفر قليلا |
| يشم | رائحة كبريتية |
| الكتلة المولية | 104.06 جم/مول |
| كثافة | 1.48 جرام/مل |
| نقطة الانصهار | 150 درجة مئوية |
| نقطة الغليان | 150 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الإيثانول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 6.97 |
| الرقم الهيدروجيني | 4.5-5.5 (محلول 5%) |
السلامة ومخاطر ثنائي كبريتيت الصوديوم
يمكن أن يكون NaHSO3 ضارًا إذا تم تناوله أو استنشاقه أو ملامسته للجلد أو العينين. وهذا يمكن أن يسبب تهيج الجلد، وتلف العين، ومشاكل في الجهاز التنفسي والجهاز الهضمي. التعرض لفترات طويلة يمكن أن يؤدي إلى مشاكل صحية أكثر خطورة. من المهم التعامل مع NaHSO3 وتخزينه بعناية، باستخدام معدات الحماية الشخصية مثل القفازات والنظارات الواقية وأجهزة التنفس. يجب أن تبقى بعيدا عن المواد القابلة للاحتراق والمواد غير المتوافقة. في حالة التلامس العرضي أو الابتلاع، يجب طلب العناية الطبية الفورية. يجب اتباع إجراءات التخزين والتعامل المناسبة لتجنب المخاطر المحتملة.
| رموز الخطر | الجمجمة والعظمتين المتقاطعتين، قابلة للتآكل |
| وصف الأمان | تجنب التلامس مع الجلد والاعين والملابس. لا استوعب أو يستنشق. استخدم معدات الحماية المناسبة. |
| أرقام تعريف الأمم المتحدة | UN2693 |
| رمز النظام المنسق | 28321000 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | سامة للغاية عن طريق الابتلاع أو الاستنشاق. قد يسبب تهيج الجلد والعين، ومشاكل في الجهاز التنفسي والهضمي. التعرض لفترات طويلة يمكن أن يسبب مشاكل صحية خطيرة. |
طرق تصنيع ثنائي كبريتيت الصوديوم
هناك طرق مختلفة لتصنيع NaHSO3، لكن الطريقة الأكثر شيوعًا تتضمن تفاعل كربونات الصوديوم وثاني أكسيد الكبريت.
لإنتاج محلول NaHSO3، قم بخلط محلول كربونات الصوديوم مع غاز ثاني أكسيد الكبريت. يطلق التفاعل حرارة ويتطلب وعاء تفاعل مزودًا بتهوية كافية.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد الصوديوم مع غاز ثاني أكسيد الكبريت لإنتاج محلول كبريتيت الصوديوم، والذي يتم تحميضه بعد ذلك لإنتاج محلول NaHSO3. بالنسبة للكميات الكبيرة من NaHSO3، تكون هذه الطريقة مفيدة.
لتصنيع NaHSO3، يتفاعل حمض الكبريتيك مع كبريتيت الصوديوم ، مما يؤدي إلى تكوين محلول NaHSO3. تكون هذه الطريقة مفيدة عند الحاجة إلى محلول أكثر تركيزًا من NaHSO3.
استخدامات ثنائي كبريتيت الصوديوم
NaHSO3 لديه مجموعة واسعة من الاستخدامات في مختلف الصناعات. فيما يلي بعض استخداماته الشائعة:
- صناعة الأغذية – تستخدم كمادة حافظة للأغذية لمنع نمو البكتيريا وإطالة العمر الافتراضي للمنتجات الغذائية مثل الفواكه والخضروات المعلبة والعصائر والنبيذ.
- معالجة المياه – يستخدم كعامل اختزال لإزالة الكلور الزائد من مياه الشرب وأنظمة معالجة مياه الصرف الصحي.
- صناعة النسيج – يستخدم كمبيض لإزالة الأصباغ المتبقية من المنسوجات.
- صناعة التصوير الفوتوغرافي – تستخدم كعامل تطوير في معالجة الصور الفوتوغرافية.
- حفر النفط – يستخدم كمثبط للتآكل وفي أنظمة الاسترداد لإزالة الأكسجين ومنع التآكل أثناء عمليات حفر النفط والغاز.
- المستحضرات الصيدلانية – تستخدم كمضاد للأكسدة وعامل اختزال في تصنيع بعض المنتجات الصيدلانية.
- العناية الشخصية – يستخدم كعامل تمليس الشعر وفي إنتاج بعض منتجات العناية الشخصية مثل الشامبو والبلسم.
- استخدامات أخرى – تستخدم في إنتاج الورق واللب، وككاشف مختبري، وكعامل خالب لأيونات المعادن.
أسئلة:
س: ما هو NaHSO3؟
ج: NaHSO3 هي الصيغة الكيميائية لثنائي كبريتيت الصوديوم، وهو ملح يستخدم لمجموعة متنوعة من الأغراض في صناعات مختلفة.
س: ما هو الرقم الهيدروجيني التقريبي لـ 0.015 M NaHSO3؟
ج: الرقم الهيدروجيني التقريبي لـ 0.015 M NaHSO3 هو 7 تقريبًا. هذا المحلول متعادل لأنه ليس حمضًا ولا قاعدة.
س: هل NaHSO3 حمضي أم قاعدي؟
ج: NaHSO3 حمضي قليلًا لأنه يمكنه التبرع بأيون الهيدروجين في الماء لتكوين أيونات HSO3- وH+.
س: ما هو رقم تأكسد الكبريت (S) في NaHSO3 أحد المواد المتفاعلة المستخدمة في هذه التجربة؟
ج: عدد تأكسد الكبريت (S) في NaHSO3 هو +4.
س: ماذا يفعل NaHSO3؟
ج: يستخدم NaHSO3 كعامل اختزال ومصدر لثاني أكسيد الكبريت. ويمكن أيضا أن يكون بمثابة مضاد للأكسدة والمواد الحافظة في المنتجات الغذائية والصيدلانية.
س: إذا كنت تريد تحضير 1.00 كجم من I2، فما هي كتل NaIO3 وNaHSO3 المطلوبة؟
ج: المعادلة الكيميائية المتوازنة للتفاعل بين NaIO3 وNaHSO3 لتكوين I2 هي: 5NaIO3 + NaHSO3 + 3H2O → 3I2 + 5NaSO4 + 3H2SO4. باستخدام قياس العناصر الكيميائية، ستحتاج إلى 3.33 كجم من NaIO3 و1.00 كجم من NaHSO3 لتحضير 1.00 كجم من I2. .
س: لماذا أضفنا ثنائي كبريتات الصوديوم في نهاية التفاعل؟
ج: يتم إضافة NaHSO3 في نهاية بعض التفاعلات الكيميائية لإزالة البروم الزائد، والذي يمكن أن يكون ضارًا أو يتعارض مع الخطوات اللاحقة في العملية.
س: ما هو ثنائي كبريتيت الصوديوم؟
ج: NaHSO3 هو ملح يستخدم لخصائصه المختزلة ومضادات الأكسدة والحافظة في مختلف الصناعات بما في ذلك الأغذية والأدوية ومعالجة المياه.
س: كيف يزيل ثنائي كبريتيت الصوديوم البروم؟
ج: يتفاعل NaHSO3 مع البروم لتكوين بروميد الصوديوم وغاز ثاني أكسيد الكبريت، مما يؤدي إلى إزالة البروم الزائد من المحلول بشكل فعال.
س: ما هو مركب ميناديون ثنائي كبريتيت الصوديوم؟
ج: مركب ميناديون ثنائي كبريتيت الصوديوم هو مركب اصطناعي يستخدم كمصدر لفيتامين K في بعض المكملات الغذائية ومنتجات أغذية الحيوانات الأليفة.
س: ما هو ثاني كبريتيت الصوديوم المستخدم؟
ج: يتم استخدام NaHSO3 كعامل اختزال ومضاد للأكسدة ومواد حافظة في العديد من الصناعات بما في ذلك الأغذية والأدوية ومعالجة المياه والتنقيب عن النفط. ويمكن استخدامه أيضًا كعامل تمليس الشعر وفي معالجة الصور الفوتوغرافية.
