فوسفات ثلاثي الصوديوم (Na3PO4) هو مركب يتكون من أيونات الصوديوم والفوسفات. وله استخدامات متعددة في صناعات مثل الأغذية والأدوية والمنظفات، لقدرته على التحكم في الحموضة والعمل كمواد عازلة.
| اسم الأيوباك | فوسفات ثلاثي الصوديوم |
| الصيغة الجزيئية | Na3PO4 |
| CAS رقم | 7601-54-9 |
| المرادفات | فوسفات الصوديوم، TSP، أورثوفوسفات الصوديوم، فوسفات الصوديوم تريباسيك، فوسفات الصوديوم الثلاثي، أورثوفوسفات ثلاثي الصوديوم |
| إنتشي | InChI=1S/3Na.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
خصائص فوسفات ثلاثي الصوديوم
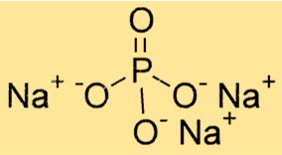
صيغة فوسفات ثلاثي الصوديوم
الصيغة الكيميائية لفوسفات ثلاثي الصوديوم هي Na3PO4. وهو يتألف من ثلاثة كاتيونات الصوديوم (Na+) وأنيون فوسفات واحد (PO43-). الصيغة مهمة لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية ولحساب كمية المادة في كمية معينة.
ثلاثي فوسفات الصوديوم الكتلة المولية
الكتلة المولية لـ Na3PO4 هي 163.94 جم/مول. ويتم حسابه عن طريق جمع الكتل الذرية للعناصر المكونة له وهي الصوديوم والفوسفور والأكسجين. الكتلة المولية هي معلمة مهمة تستخدم لتحديد كمية المادة الموجودة في كمية معينة. كما أنها تستخدم لحساب قياس العناصر الكيميائية للتفاعلات الكيميائية.
نقطة غليان فوسفات ثلاثي الصوديوم
درجة غليان Na3PO4 هي 1587 درجة مئوية. هذه هي درجة الحرارة التي تتحول عندها الحالة السائلة إلى الحالة الغازية. تعتمد درجة غليان المادة على عوامل مختلفة، مثل الضغط ودرجة الحرارة والقوى الجزيئية. ترجع نقطة الغليان العالية لـ Na3PO4 إلى طبيعته الأيونية وقوى الجزيئات القوية.
نقطة انصهار فوسفات ثلاثي الصوديوم
نقطة انصهار Na3PO4 هي 1340 درجة مئوية. هذه هي درجة الحرارة التي تتحول عندها المادة الصلبة إلى الحالة السائلة. تعتمد نقطة انصهار المادة على عوامل مختلفة، مثل الضغط ودرجة الحرارة والقوى الجزيئية. ترجع نقطة الانصهار العالية لـ Na3PO4 إلى طبيعته الأيونية وقوى الجزيئات القوية.
كثافة فوسفات ثلاثي الصوديوم جم/مل
تبلغ كثافة Na3PO4 2.54 جم / مل. الكثافة هي قياس كتلة المادة لكل وحدة حجم. إنها خاصية فيزيائية مهمة للمادة تستخدم لتحديد كتلتها أو حجمها. ترجع الكثافة العالية لـ Na3PO4 إلى طبيعته الأيونية وجزيئاته المتراصة بإحكام.
الوزن الجزيئي لفوسفات ثلاثي الصوديوم
الوزن الجزيئي لـ Na3PO4 هو 163.94 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. يعد الوزن الجزيئي لـ Na3PO4 مهمًا لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية ولحساب كمية المادة بكمية معينة.
هيكل فوسفات ثلاثي الصوديوم
يحتوي Na3PO4 على بنية بلورية ذات ترتيب سداسي من الذرات المتراصة بشكل وثيق. توجد كاتيونات الصوديوم في الفجوات بين أنيونات الأكسجين المضغوطة. يتكون أنيون الفوسفات من ذرة فوسفور واحدة وأربع ذرات أكسجين، مرتبة على شكل رباعي السطوح.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 2,536 جم/سم3 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 163.94 جرام/مول |
| كثافة | 2.54 جم/مل |
| نقطة الانصهار | 1340 درجة مئوية |
| نقطة الغليان | 1,587 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء وغير قابل للذوبان في المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | pKa1 = 2.15، pKa2 = 7.20، pKa3 = 12.35 |
| الرقم الهيدروجيني | الرقم الهيدروجيني لمحلول 0.1 م = 11.5 |
سلامة ومخاطر ثلاثي فوسفات الصوديوم
يعتبر Na3PO4 بشكل عام آمنًا للاستخدام في الأطعمة والأدوية والتطبيقات الأخرى. ومع ذلك، مثل أي مادة كيميائية، يمكن أن تشكل مخاطر إذا تم التعامل معها بشكل سيء. تناول كميات كبيرة من Na3PO4 يمكن أن يؤدي إلى مشاكل في الجهاز الهضمي مثل الإسهال والغثيان والقيء. قد يؤدي ملامسة العين والجلد للمادة إلى حدوث تهيج وحروق. من المهم التعامل مع Na3PO4 بعناية، وارتداء معدات الحماية الشخصية المناسبة، واتباع جميع إجراءات السلامة عند التعامل مع هذه المادة. في حالة الابتلاع أو التعرض العرضي، اطلب العناية الطبية على الفور.
| رموز الخطر | لا أحد |
| وصف الأمان | استخدم مع التهوية الكافية. تجنب ملامسة الجلد والعينين. ارتداء معدات الحماية. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 28352200 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة. تناول كميات كبيرة قد يسبب مشاكل في الجهاز الهضمي. قد يسبب تهيجًا وحروقًا عند ملامسته للجلد والعينين. |
طرق تصنيع فوسفات ثلاثي الصوديوم
هناك عدة طرق لتصنيع Na3PO4، بما في ذلك تفاعل هيدروكسيد الصوديوم مع حمض الفوسفوريك ، وتفاعل كربونات الصوديوم مع حمض الفوسفوريك، وتفاعل كلوريد الصوديوم مع حمض الفوسفوريك في وجود كربونات الصوديوم.
تتضمن الطريقة الشائعة تفاعل هيدروكسيد الصوديوم (NaOH) مع حمض الفوسفوريك (H3PO4) . ينتج عن هذا التفاعل Na3PO4 (Na3PO4) وماء (H2O). المعادلة الكيميائية المتوازنة لهذا التفاعل هي:
3 هيدروكسيد الصوديوم + H3PO4 → Na3PO4 + 3 H2O
هناك طريقة أخرى تتضمن تفاعل كربونات الصوديوم (Na2CO3) مع حمض الفوسفوريك (H3PO4) . ينتج عن هذا التفاعل Na3PO4 (Na3PO4)، وثاني أكسيد الكربون (CO2) والماء (H2O). المعادلة الكيميائية المتوازنة لهذا التفاعل هي:
Na2CO3 + 2 H3PO4 → 2 Na3PO4 + 3 CO2 + 3 H2O
الطريقة الثالثة تتضمن تفاعل كلوريد الصوديوم (NaCl) مع حمض الفوسفوريك (H3PO4) في وجود كربونات الصوديوم (Na2CO3) . ينتج عن هذا التفاعل Na3PO4 (Na3PO4)، وكلوريد الصوديوم (NaCl)، وثاني أكسيد الكربون (CO2)، والماء (H2O). المعادلة الكيميائية المتوازنة لهذا التفاعل هي:
3 كلوريد الصوديوم + H3PO4 + Na2CO3 → Na3PO4 + 3 كلوريد الصوديوم + 3 CO2 + 3 H2O
تستخدم الصناعات هذه الطرق على نطاق واسع لإنتاج Na3PO4 لمختلف التطبيقات.
استخدامات فوسفات ثلاثي الصوديوم
Na3PO4 له العديد من الاستخدامات في مختلف الصناعات بسبب خصائصه الفريدة. بعض الاستخدامات الشائعة لـ Na3PO4 هي:
- صناعة الأغذية: تستخدم كمضافات غذائية لتحسين الملمس والنكهة ومدة صلاحية المنتجات الغذائية المصنعة.
- صناعة الأدوية: تستخدم في إنتاج المنتجات الصيدلانية المختلفة، بما في ذلك الملينات ومضادات الحموضة ومحاليل الإلكتروليت.
- معالجة المياه: تستخدم في عمليات معالجة المياه للتحكم في تكوين القشور ومنع التآكل في أنظمة توزيع المياه.
- صناعة المنظفات: تستخدم في إنتاج المنظفات لتحسين خصائصها التنظيفية.
- الزراعة: يستخدم كسماد ومحسن للتربة في الزراعة لتوفير العناصر الغذائية الأساسية للنباتات.
- التطبيقات الصناعية: يستخدم في العمليات الصناعية المختلفة بما في ذلك معالجة الأسطح المعدنية وإنتاج السيراميك وكمثبط للهب.
- التطبيقات المخبرية: يستخدم في العديد من التطبيقات المخبرية بما في ذلك تنقية الحمض النووي والبروتين، والمحاليل المنظمة وكمنظم للأس الهيدروجيني.
أسئلة:
س: هل Na3PO4 قابل للذوبان في الماء؟
ج: نعم، Na3PO4 قابل للذوبان بدرجة عالية في الماء.
س: ما هو التركيز المولي لأيونات الصوديوم في محلول 0.350 M Na3PO4؟
ج: في محلول Na3PO4 تركيزه 0.350 M، يكون التركيز المولي لأيونات الصوديوم 1.05 M.
س: هل Na3PO4 حمض أم قاعدة؟
ج: Na3PO4 هو ملح أساسي.
س: ما هي المعادلة الأيونية الصافية للتفاعل بين المحاليل المائية لـ Na3PO4 و CuSO4؟
ج: المعادلة الأيونية الصافية للتفاعل بين المحاليل المائية لـ Na3PO4 وCuSO4 هي: 2Na+(aq) + Cu2+(aq) + 2PO43-(aq) + SO42-(aq) → Cu3(PO4)2(s) + 2Na+ (عبد القدير) + SO42-(عبد القدير).
س: ما حجم محلول Na3PO4 تركيزه 3.50 M الذي يجب استخدامه لتحضير 1.50 لتر من محلول Na3PO4 تركيزه 2.55 M؟
ج: لتحضير محلول 2.55 M Na3PO4 باستخدام محلول 3.50 M Na3PO4، ستحتاج إلى استخدام 0.921 لتر من المحلول 3.50 M.
س: ما هو فوسفات ثلاثي الصوديوم؟
ج: فوسفات ثلاثي الصوديوم هو ملح فوسفات الصوديوم غير العضوي، له الصيغة الكيميائية Na3PO4.
س: هل ثلاثي فوسفات الصوديوم قابل للذوبان؟
ج: نعم، فوسفات ثلاثي الصوديوم شديد الذوبان في الماء.
س: كيف تعرف إذا كان المسحوق الأبيض الموجود لديك هو بيكربونات الصوديوم أو فوسفات ثلاثي الصوديوم؟
ج: إحدى الطرق للتمييز بين بيكربونات الصوديوم وNa3PO4 هي إجراء اختبار بسيط للأس الهيدروجيني. بيكربونات الصوديوم أساسية وتعطي درجة حموضة أعلى من 7، بينما Na3PO4 محايدة وتعطي درجة حموضة 7.
س: ما هي صيغة فوسفات ثلاثي الصوديوم؟
ج: صيغة فوسفات ثلاثي الصوديوم هي Na3PO4.
