ثلاثي بروميد الفوسفور (PBr3) مركب يتكون من ذرة فوسفور واحدة وثلاث ذرات بروم. يتم استخدامه ككاشف في التفاعلات الكيميائية المختلفة، وخاصة في تركيب المركبات العضوية.
| اسم الأيوباك | ثلاثي بروميد الفوسفور |
| الصيغة الجزيئية | بي بي آر 3 |
| CAS رقم | 7789-60-8 |
| المرادفات | بروميد الفوسفور (III)، بروميد الفوسفور، ثلاثي بروموفوسفين |
| إنتشي | إنتشي=1S/Br3P/c1-4(2)3 |
خصائص ثلاثي بروميد الفوسفور
صيغة ثلاثي بروميد الفوسفور
صيغة بروميد الفوسفور (III) هي PBr3. ويتكون من ذرة فوسفور واحدة وثلاث ذرات بروم. يتكون هذا المركب عندما يتفاعل الفوسفور مع البروم. تمثل الصيغة بدقة تكوين المركب.
ثلاثي بروميد الفوسفور الكتلة المولية
يمكن حساب الكتلة المولية لبروميد الفوسفور (III) عن طريق إضافة الكتل الذرية للعناصر المكونة له. يمتلك الفوسفور كتلة ذرية تبلغ حوالي 31.0 جرامًا لكل مول، بينما تبلغ الكتلة الذرية للبروم حوالي 79.9 جرامًا لكل مول. إن إضافة ثلاثة أضعاف الكتلة الذرية للبروم إلى الكتلة الذرية للفوسفور يعطينا الكتلة المولية لبروميد الفوسفور (III)، والتي تبلغ حوالي 270.7 جرامًا لكل مول.
نقطة غليان ثلاثي بروميد الفوسفور
بروميد الفوسفور (III) لديه نقطة غليان تبلغ حوالي 173 درجة مئوية. وهذا يعني أنه عند درجات حرارة أعلى من هذه النقطة، سيخضع المركب لتغير طوري من السائل إلى الغاز. تعتبر نقطة الغليان خاصية مهمة تساعد في تحديد الظروف التي يمكن فيها استخدام المركب أو تنقيته.
نقطة انصهار ثلاثي بروميد الفوسفور
تبلغ نقطة انصهار بروميد الفوسفور (III) حوالي -41 درجة مئوية. تشير درجة الحرارة هذه إلى النقطة التي يتحول عندها المركب من الحالة الصلبة إلى الحالة السائلة. تعد معرفة نقطة الانصهار أمرًا بالغ الأهمية للتعامل مع المركب ومعالجته في العمليات الكيميائية المختلفة.
كثافة ثلاثي بروميد الفوسفور جم/مل
تبلغ كثافة بروميد الفوسفور (III) حوالي 2.85 جرام لكل ملليلتر (جم / مل). تقيس الكثافة كتلة المادة لكل وحدة حجم. بكثافته العالية نسبيًا، يعتبر بروميد الفوسفور (III) أكثر كثافة من العديد من السوائل الشائعة الأخرى، مما يشير إلى أنه ثقيل نسبيًا بالنسبة لحجمه.
الوزن الجزيئي لثلاثي بروميد الفوسفور
يبلغ الوزن الجزيئي لبروميد الفوسفور (III) حوالي 270.7 جرامًا لكل مول. يتم حساب هذه القيمة عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في المركب، بناءً على الصيغة الجزيئية PBr3. الوزن الجزيئي مفيد في العديد من الحسابات، بما في ذلك تحديد كمية المادة الموجودة في كتلة معينة.
هيكل ثلاثي بروميد الفوسفور
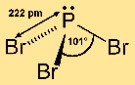
يحتوي بروميد الفوسفور (III) على بنية جزيئية هرمية. وتتكون من ذرة فسفور مركزية مرتبطة بثلاث ذرات بروم. يعطي هذا الترتيب للجزيء شكلًا هرميًا ثلاثيًا، حيث تكون ذرة الفوسفور في الأعلى وذرات البروم في القاعدة. هذا الهيكل مهم لفهم تفاعل وسلوك المركب في التفاعلات الكيميائية.
ذوبان ثلاثي بروميد الفوسفور
بروميد الفوسفور (III) قليل الذوبان في الماء. يتفاعل مع الماء لينتج حمض الهيدروبروميك وحمض الفوسفور. ومع ذلك، فهو قابل للذوبان في المذيبات العضوية مثل البنزين ورابع كلوريد الكربون. تحدد قابلية الذوبان مدى قدرة المركب على الذوبان في مذيب معين، الأمر الذي له آثار على تطبيقاته ومعالجته في العمليات المختلفة.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 2.85 جرام/مل |
| لون | عديم اللون |
| يشم | فدان |
| الكتلة المولية | 270.7 جرام/مول |
| كثافة | 2.85 جرام/مل |
| نقطة الانصهار | -41 درجة مئوية |
| نقطة الغليان | 173 درجة مئوية |
| نقطة فلاش | غير متاح |
| الذوبان في الماء | يتفاعل |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل البنزين ورابع كلوريد الكربون |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | غير متاح |
السلامة ومخاطر ثلاثي بروميد الفوسفور
يشكل بروميد الفوسفور (III) بعض مخاطر السلامة ويجب التعامل معه بحذر. وهو مادة أكالة ويمكن أن يسبب حروقًا شديدة عند ملامسته للجلد أو العينين أو الجهاز التنفسي. استنشاق هذا المركب أو تناوله مباشرة قد يسبب تهيج الجهاز التنفسي والجهاز الهضمي. يتفاعل بعنف مع الماء، ويطلق أبخرة سامة ويولد الحرارة. يجب استخدام التهوية الكافية ومعدات الحماية الشخصية، مثل القفازات والنظارات الواقية، عند العمل مع بروميد الفوسفور (III). بالإضافة إلى ذلك، يجب تخزينه بعيدًا عن المواد غير المتوافقة لتجنب التفاعلات المحتملة. بشكل عام، يعد الالتزام الصارم ببروتوكولات السلامة ومعرفة المخاطر المرتبطة بهذا المركب أمرًا ضروريًا للتعامل الآمن.
| رموز الخطر | تآكل |
| وصف الأمان | التعامل مع الودائع. تجنب ملامسة الجلد والعينين والجهاز التنفسي. استخدم التهوية الكافية ومعدات الحماية الشخصية. يُحفظ بعيداً عن المواد غير المتوافقة. |
| أرقام تعريف الأمم المتحدة | UN1805 |
| رمز النظام المنسق | 2812.90.90 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | ثانيا |
| تسمم | سامة عن طريق الاستنشاق والابتلاع. قد يسبب حروقًا وتهيجًا شديدًا. |
طرق تخليق ثلاثي بروميد الفوسفور
في إحدى الطرق الشائعة لتخليق بروميد الفوسفور (III)، يجمع وعاء التفاعل مباشرة بين عنصري الفوسفور والبروم، عادة تحت ظروف خاضعة للرقابة. يستمر التفاعل بانتقال ذرات البروم إلى ذرات الفوسفور، مما يؤدي إلى تكوين بروميد الفوسفور (III).
تتضمن الطريقة الأخرى التفاعل بين ثلاثي كلوريد الفوسفور (PCl3) وبروميد الهيدروجين (HBr) . في هذا النهج، يتفاعل ثلاثي كلوريد الفوسفور أولاً مع غاز بروميد الهيدروجين، منتجًا بروميد الفوسفور (III) وغاز كلوريد الهيدروجين كمنتجات ثانوية. توفر هذه الطريقة طريقًا بديلاً للحصول على بروميد الفوسفور (III).
في “طريقة الفوسفور الأحمر”، يتم دمج الفسفور الأحمر مع البروم أو حمض الهيدروبروميك ويتم التفاعل تحت ظروف خاضعة للرقابة. يعمل الفسفور الأحمر كمصدر للفسفور، حيث يتفاعل مع البروم أو حمض الهيدروبروميك لإنتاج بروميد الفوسفور (III).
تفتح هذه الطرق الاصطناعية آفاقًا لإنتاج بروميد الفوسفور (III)، ولكل منها مزاياها واعتباراتها الخاصة. يعتمد اختيار الطريقة على عوامل مثل توفر الكاشف، والإنتاج المطلوب، وظروف التفاعل المحددة. ومن المهم إجراء هذه التوليفات في مختبر مجهز تجهيزًا جيدًا، مع احترام بروتوكولات السلامة وإجراءات التعامل مع المواد الكيميائية المعنية.
استخدامات ثلاثي بروميد الفوسفور
يجد بروميد الفوسفور (III) تطبيقات مختلفة بسبب تفاعله وخصائصه الفريدة. وهنا بعض من استخداماته:
- التخليق العضوي: يستخدم الكيميائيون على نطاق واسع بروميد الفوسفور (III) ككاشف في التخليق العضوي لتحويل الكحول إلى بروميدات الألكيل، وهي خطوة أساسية في تخليق العديد من المركبات العضوية.
- صناعة المستحضرات الصيدلانية: يعتمد إنتاج المستحضرات الصيدلانية بشكل كبير على بروميد الفوسفور (III) لتجميع مختلف الأدوية الوسيطة والمكونات الصيدلانية النشطة (API).
- مثبطات اللهب: يستخدم المصنعون بروميد الفوسفور (III) في إنتاج مثبطات اللهب، مما يحسن خصائص مقاومة الحريق لبعض البوليمرات لاستخدامها في صناعات مثل الإلكترونيات والمنسوجات.
- التصنيع الكيميائي: يعمل بروميد الفوسفور (III) كوسيط قيم في إنتاج المواد الكيميائية الأخرى، بما في ذلك مركبات الفسفور مثل مشتقات حمض الفوسفوريك، والفوسفونات، والفوسفات.
- مبيدات الأعشاب ومبيدات الآفات: يستخدم تخليق المكونات النشطة المحددة المستخدمة في مبيدات الأعشاب ومبيدات الآفات بروميد الفوسفور (III) للسيطرة بشكل فعال على الأعشاب الضارة والآفات والأمراض في الزراعة.
- الأبحاث المعملية: في المختبر، يستخدم الباحثون عادة بروميد الفوسفور (III) ككاشف في التجارب والتفاعلات المختلفة، وخاصة تلك التي تنطوي على المعالجة بالبروم والمركبات العضوية.
- التحليل الكيميائي: يجد بروميد الفوسفور (III) تطبيقًا في تقنيات التحليل الكيميائي، مما يسمح بتحديد وجود مجموعات وظيفية محددة في المركبات العضوية من خلال تفاعلات استبدال البروم.
تسلط هذه الاستخدامات المتنوعة الضوء على أهمية بروميد الفوسفور (III) في التخليق العضوي، والمستحضرات الصيدلانية، ومثبطات اللهب، والتصنيع الكيميائي، والزراعة، والأبحاث المعملية، والتحليل الكيميائي. تفاعله وتعدد استخداماته يجعله مركبًا قيمًا في مختلف الصناعات والتخصصات العلمية.
أسئلة:
س: لماذا يسمى AlBr3 بروميد الألومنيوم بينما PBr3 هو ثلاثي بروميد الفوسفور؟
ج: إن اصطلاح تسمية المركبات التي تحتوي على معادن يستخدم عمومًا الاسم العنصري للمعدن متبوعًا باسم اللافلز، بينما في حالة PBr3، يتم تحديد الفوسفور للإشارة إلى وجود ذرة فسفور مركزية.
س: ما هي الكلمة أو العبارة المكونة من كلمتين التي تصف بشكل أفضل شكل ثلاثي بروميد الفوسفور؟
ج: أفضل وصف لشكل بروميد الفوسفور (III) هو أنه هرمي ثلاثي.
س: ما عدد إلكترونات التكافؤ الموجودة في جزيء ثلاثي بروميد الفوسفور PBr3؟
ج: يحتوي بروميد الفوسفور (III) (PBr3) على 26 إلكترونًا تكافؤًا.
س: هل ثلاثي بروميد الفوسفور أيوني أم تساهمي؟
ج: بروميد الفوسفور (III) (PBr3) مركب تساهمي.
س: ما هي الصيغة الكيميائية لثلاثي بروميد الفوسفور؟
ج: الصيغة الكيميائية لبروميد الفوسفور (III) هي PBr3.
س: تركيب لويس لثلاثي بروميد الفوسفور، PBr3؟
ج: يُظهر تركيب لويس لـ PBr3 الفوسفور كذرة مركزية محاطة بثلاث ذرات بروم مرتبطة، ترتبط كل منها برابطة واحدة.
س: هل PBr3 هو انعكاس؟
ج: لا، بروميد الفسفور (III) (PBr3) لا يظهر انقلابًا.
س: هل PBr3 محب للكهرباء؟
ج: نعم، يمكن أن يعمل PBr3 كمحب للإلكترونات في بعض التفاعلات، حيث يقبل الإلكترونات.
س: ما هي الهندسة الجزيئية لـ PBr3؟
ج: الهندسة الجزيئية لـ PBr3 هي هرمية مثلثية.
س: هل PBr3 قطبي أم غير قطبي؟
ج: PBr3 هو جزيء قطبي بسبب التوزيع غير المتساوي لكثافة الإلكترون الناتج عن وجود روابط P-Br القطبية.
س: كم عدد مولات PBr3 التي تحتوي على 3.68 × 10^25 ذرات بروم؟
ج: لتحديد عدد المولات، نحتاج إلى الكتلة المولية لـ PBr3، ثم نقسم العدد المعطى من ذرات البروم على رقم أفوجادرو.
س: ما هو الاسم الصحيح لـ PBr3؟
ج: الاسم الصحيح لـ PBr3 هو بروميد الفوسفور (III).
س: هل PBr3 قطبي؟
ج: نعم، PBr3 هو جزيء قطبي بسبب وجود الروابط القطبية والتوزيع غير المتساوي لكثافة الإلكترون.
