بيكربونات الليثيوم (LiHCO3) هو مركب كيميائي يستخدم في تطبيقات مختلفة. له خصائص قلوية ويستخدم في الأبحاث وفي المستحضرات الصيدلانية وكعلاج محتمل لبعض الحالات الطبية.
| اسم الأيوباك | بيكربونات الليثيوم |
| الصيغة الجزيئية | LiHCO3 |
| CAS رقم | 5006-97-3 |
| المرادفات | كربونات هيدروجين الليثيوم، بيكربونات الليثيوم |
| إنتشي | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
خصائص بيكربونات الليثيوم
صيغة بيكربونات الليثيوم
كربونات هيدروجين الليثيوم لها الصيغة الكيميائية LiHCO3. وهو يتألف من كاتيون الليثيوم (Li)، وأنيون كربونات الهيدروجين (HCO3) وذرة الهيدروجين (H). تعكس الصيغة وجود أيونات الليثيوم والبيكربونات في المركب.
الكتلة المولية لبيكربونات الليثيوم
تبلغ الكتلة المولية لكربونات هيدروجين الليثيوم (LiHCO3) حوالي 68 جرامًا لكل مول (جم / مول). ويتم حسابه عن طريق إضافة الكتل الذرية للعناصر المكونة له: الليثيوم والهيدروجين والكربون والأكسجين.
درجة غليان بيكربونات الليثيوم
لا تحتوي كربونات هيدروجين الليثيوم على نقطة غليان محددة جيدًا لأنها تتحلل عند درجات حرارة عالية. وعندما يسخن، فإنه يفقد ثاني أكسيد الكربون (CO2) والماء (H2O)، ويتحول إلى كربونات الليثيوم (Li2CO3).
نقطة انصهار بيكربونات الليثيوم
تبلغ درجة انصهار كربونات هيدروجين الليثيوم حوالي 250 درجة مئوية (482 درجة فهرنهايت). عند درجة الحرارة هذه، فإنه يخضع لمرحلة انتقالية من الحالة الصلبة إلى الحالة السائلة.
كثافة بيكربونات الليثيوم جم/مل
تبلغ كثافة كربونات هيدروجين الليثيوم (LiHCO3) حوالي 2.21 جرام لكل ملليلتر (جم/مل). وهو مركب كثيف نسبيًا بسبب وجود الليثيوم والعناصر الثقيلة الأخرى.
الوزن الجزيئي لبيكربونات الليثيوم
يبلغ الوزن الجزيئي لكربونات هيدروجين الليثيوم حوالي 68 جم/مول. يمثل الوزن الجزيئي مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء واحد من المركب.
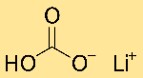
هيكل بيكربونات الليثيوم
كربونات هيدروجين الليثيوم لها بنية بلورية. وهي تشكل شبكة من ذرات الليثيوم وكربونات الهيدروجين والهيدروجين، مرتبة في نمط متكرر. يتم تثبيت الهيكل معًا بواسطة روابط أيونية وتساهمية.
ذوبان بيكربونات الليثيوم
كربونات هيدروجين الليثيوم ضعيفة الذوبان في الماء. يذوب إلى حد ما في الماء، مما يعطي محلول قلوي قليلا. ومع ذلك، فإن قابليته للذوبان منخفضة نسبيًا مقارنة بمركبات الليثيوم الأخرى.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | ~2.21 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | ~68 جم/مول |
| كثافة | ~2.21 جم/مل |
| نقطة الانصهار | ~250 درجة مئوية (482 درجة فهرنهايت) |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان قليلا، وإعطاء محلول قلوي قليلا |
| الذوبان | حد |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | قلوية قليلا |
سلامة ومخاطر بيكربونات الليثيوم
تحتوي كربونات هيدروجين الليثيوم على اعتبارات ومخاطر معينة تتعلق بالسلامة. من الضروري التعامل مع المركب بعناية لتقليل المخاطر. التلامس المباشر مع الجلد أو العينين قد يسبب تهيجًا. يجب تجنب استنشاق الغبار أو الأبخرة، لأن ذلك قد يسبب عدم الراحة في الجهاز التنفسي. عند تسخينه، فإنه يتحلل، ويطلق ثاني أكسيد الكربون وبخار الماء، والذي يمكن أن يكون خطيرًا في الأماكن المغلقة. بالإضافة إلى ذلك، من الضروري تخزين كربونات هيدروجين الليثيوم بشكل صحيح، بعيدًا عن المواد غير المتوافقة. يجب استخدام التهوية الكافية ومعدات الحماية الشخصية عند العمل مع هذا المركب لضمان بيئة آمنة.
| رموز الخطر | غير متاح |
| وصف الأمان | التعامل مع الرعاية. تجنب الاستنشاق وملامسة الجلد والعينين. قم بالتخزين بشكل صحيح. استخدام في مناطق جيدة التهوية. |
| أرقام تعريف الأمم المتحدة | غير متاح |
| رمز النظام المنسق | غير متاح |
| فئة الخطر | غير متاح |
| مجموعة التعبئة | غير متاح |
| تسمم | سمية منخفضة. التعامل مع الودائع. |
طرق تصنيع بيكربونات الليثيوم
تسمح الطرق المختلفة بتخليق كربونات هيدروجين الليثيوم.
الطريقة الشائعة هي تفاعل هيدروكسيد الليثيوم (LiOH) مع ثاني أكسيد الكربون (CO2). يحدث التفاعل في محلول مائي حيث يتفكك هيدروكسيد الليثيوم إلى أيونات الليثيوم والهيدروكسيد. وفي الوقت نفسه، يذوب ثاني أكسيد الكربون في الماء، مكونًا حمض الكربونيك (H2CO3) . تتفاعل أيونات الليثيوم بعد ذلك مع حمض الكربونيك لإنتاج كربونات هيدروجين الليثيوم (LiHCO3) والماء (H2O). المعادلة الكيميائية لهذا التفاعل هي:
LiOH + CO2 → LiHCO3 + H2O
تتضمن الطريقة الأخرى معالجة كربونات الليثيوم (Li2CO3) مع ثاني أكسيد الكربون في نظام مغلق، لإنتاج بيكربونات الليثيوم. المعادلة الكيميائية لهذا التفاعل هي:
Li2CO3 + CO2 → 2LiHCO3
تعتبر طرق التوليف هذه مهمة لإنتاج كربونات هيدروجين الليثيوم في المختبر وللتطبيقات الصناعية. ومن الأهمية بمكان اتباع بروتوكولات السلامة وضمان المعدات والظروف المناسبة أثناء عملية التوليف.
استخدامات بيكربونات الليثيوم
تجد كربونات هيدروجين الليثيوم العديد من التطبيقات بسبب خصائصها الفريدة. فيما يلي بعض استخداماته الرئيسية:
- الأبحاث والمختبرات: يعمل ككاشف قيم في مختلف التجارب الكيميائية والبحثية، مما يسمح للعلماء بدراسة التفاعلات والخصائص الكيميائية.
- العلاج الطبي المحتمل: تجري الدراسات حول دوره المحتمل كعلاج لأمراض مثل نقص الليثيوم وبعض اضطرابات الكلى، وكذلك كعامل قلوي.
- التطبيقات البيئية: يمكن أن تساهم في إزالة ثاني أكسيد الكربون من العمليات الصناعية ولها تطبيقات محتملة في التخفيف من انبعاثات الغازات الدفيئة.
- عامل القلوية: في عمليات صناعية معينة، يعمل كعامل قلوي للتحكم في الحموضة وتنظيم مستويات الرقم الهيدروجيني.
- صناعة الأدوية: تستخدم التركيبات الصيدلانية كربونات هيدروجين الليثيوم بشكل أساسي في أدوية اضطرابات المزاج مثل الاضطراب ثنائي القطب.
- إنتاج بطاريات الليثيوم: يستكشف الباحثون والدوائر التجريبية استخدام كربونات هيدروجين الليثيوم في بطاريات الليثيوم المتقدمة لتحسين أداء البطارية.
- معالجة المياه: تستخدم عمليات معالجة المياه بيكربونات الليثيوم لضبط الرقم الهيدروجيني لمصادر المياه.
- الزراعة: لا تجد كربونات هيدروجين الليثيوم استخداماً محدوداً في الممارسات الزراعية، حيث يستخدمها المزارعون لمعالجة ظروف معينة في التربة وتحسين نمو النباتات.
على الرغم من هذه التطبيقات، فمن الأهمية بمكان التعامل مع كربونات هيدروجين الليثيوم بعناية واتباع احتياطات السلامة، نظرا لمخاطرها المحتملة وتفاعلها. مع استمرار الأبحاث والتقدم التكنولوجي، قد تظهر استخدامات جديدة لكربونات هيدروجين الليثيوم، مما يزيد من أهميتها في مختلف المجالات.
أسئلة:
س: ما هي الصيغة الكيميائية لبيكربونات الليثيوم؟
ج: الصيغة الكيميائية لكربونات هيدروجين الليثيوم هي LiHCO3.
س: هل يمكن أن يسبب بيكربونات الليثيوم انخفاض فيتامين د؟
ج: لا يوجد دليل يشير إلى أن كربونات هيدروجين الليثيوم تسبب انخفاض مستويات فيتامين د.
س: أيهما أفضل: كربونات الليثيوم أم بيكربونات الليثيوم؟
ج: تعتمد فعالية كربونات الليثيوم أو بيكربونات الليثيوم على تطبيقاتها المحددة والاستخدام المقصود.
س: هل يتفاعل بيكربونات الليثيوم مع مستخلص الناردين؟
ج: لا توجد تفاعلات معروفة بين كربونات هيدروجين الليثيوم ومستخلص حشيشة الهر، ولكن التشاور مع أخصائي الرعاية الصحية أمر ضروري.
س: ما هو بيكربونات الليثيوم؟
ج: كربونات هيدروجين الليثيوم عبارة عن مركب كيميائي له خصائص قلوية، ويستخدم في مجموعة متنوعة من التطبيقات بما في ذلك الأبحاث والمستحضرات الصيدلانية.
س: هل يمكن تسخين بيكربونات الليثيوم وكربونات الليثيوم في الماء؟
ج: يمكن تسخين كربونات هيدروجين الليثيوم وكربونات الليثيوم في الماء، لكنهما سوف يتحللان لتكوين مركبات أخرى.
س: ما هو فقدان الوزن عند تحلل 3.45 جم من LiHCO3؟
ج: إن فقدان الوزن عند تحلل 3.45 جم من LiHCO3 سيعتمد على التفاعل المحدد والمنتجات المتكونة.
س: هل LiHCO3 إلكتروليت قوي؟
ج: لا، كربونات هيدروجين الليثيوم (LiHCO3) عبارة عن إلكتروليت ضعيف.
س: ما الملح الناتج من تفاعل H2SO4 مع LiHCO3؟
ج: التفاعل بين H2SO4 وLiHCO3 سوف ينتج كبريتات الليثيوم (Li2SO4) وثاني أكسيد الكربون (CO2) والماء (H2O).
س: هل LiHCO3 حمض أم قاعدة؟
ج: تعمل كربونات هيدروجين الليثيوم (LiHCO3) كقاعدة بسبب خصائصها القلوية.
س: هل يتفاعل N-ميثيلثانامين مع LiHCO3؟
ج: إن تفاعل N-ميثيليثانامين مع LiHCO3 سيعتمد على ظروف التفاعل المحددة والمنتجات المطلوبة.
