بيكربونات البوتاسيوم (KHCO3) بمثابة ملح بلوري أبيض، يستخدم على نطاق واسع كعامل ترك في الخبز، كعامل إطفاء الحرائق، وتحييد حموضة التربة في الزراعة. بالإضافة إلى ذلك، فهو بمثابة مكمل غذائي ويلعب دورًا في علاجات طبية محددة.
| اسم الأيوباك | كربونات هيدروجين البوتاسيوم |
| الصيغة الجزيئية | KHCO3 |
| CAS رقم | 298-14-6 |
| المرادفات | كربونات هيدروجين البوتاسيوم، ملح حمض البوتاسيوم، كربونات هيدروجين البوتاسيوم، PCN 0775، E501 |
| إنتشي | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
خصائص بيكربونات البوتاسيوم
صيغة بيكربونات البوتاسيوم
صيغة بيكربونات البوتاسيوم هي KHCO3. تشير هذه الصيغة إلى اتحاد أيون البوتاسيوم (K+) مع أيون البيكربونات (HCO3-) لتكوين جزيء بيكربونات البوتاسيوم. الصيغة مهمة في الكيمياء لأنها توفر معلومات حول أنواع وعدد الذرات التي تشكل الجزيء.
كربونات البوتاسيوم الكتلة المولية
KHCO3 لديه كتلة مولية تبلغ 100.115 جم / مول. وهذا يعني أن مول واحد من KHCO3 يحتوي على 100.115 جرام من المركب. تعد الكتلة المولية خاصية مهمة للمركب لأنها تستخدم لحساب كمية المادة اللازمة للتفاعل الكيميائي. بالإضافة إلى ذلك، يمكن استخدام الكتلة المولية لتحويل الجرام والشامات من المادة.
درجة غليان بيكربونات البوتاسيوم
لم يتم تحديد درجة غليان KHCO3 بشكل جيد لأنه يتحلل قبل الوصول إلى نقطة الغليان. عند تسخينه، يتحلل KHCO3 إلى كربونات البوتاسيوم وثاني أكسيد الكربون والماء. لذلك، يتم استخدام درجة حرارة تحلل KHCO3 لوصف ثباته الحراري.
نقطة انصهار بيكربونات البوتاسيوم
KHCO3 لديه نقطة انصهار تبلغ 292 درجة مئوية. عند درجة الحرارة هذه، يتغير KHCO3 من الحالة الصلبة إلى الحالة السائلة. تعد نقطة انصهار المركب خاصية فيزيائية مهمة لأنها تحدد الظروف التي يمكن في ظلها صهر المركب ومعالجته.
كثافة بيكربونات البوتاسيوم جم/مل
تبلغ كثافة KHCO3 2.17 جم / مل. الكثافة هي مقياس لكمية الكتلة لكل وحدة حجم. الكثافة العالية لـ KHCO3 تجعله مركبًا مفيدًا في تطبيقات مثل طفايات الحريق، حيث يتم استخدامه لإطفاء حرائق الفئة ب.
الوزن الجزيئي لبيكربونات البوتاسيوم
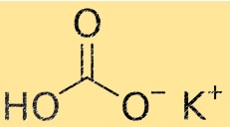
الوزن الجزيئي لـ KHCO3 هو 100.115 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. هذه الخاصية مهمة في الكيمياء لأنها تستخدم لحساب كمية المادة اللازمة للتفاعل الكيميائي.
هيكل بيكربونات البوتاسيوم
يحتوي KHCO3 على بنية بلورية مشابهة لكلوريد الصوديوم. يتكون المركب من أيونات البوتاسيوم (K+) وأيونات البيكربونات (HCO3-). تحتل أيونات البوتاسيوم مواقع أيونات الصوديوم في التركيب البلوري لكلوريد الصوديوم، بينما تحتل أيونات البيكربونات مواقع أيونات الكلوريد.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 2.17 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 100.115 جم/مول |
| كثافة | 2.17 جم/سم3 |
| نقطة الانصهار | 292 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 25 جم/100 مل (20 درجة مئوية) |
| الذوبان | يذوب في الماء |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 10.3 (حمض الكربونيك) |
| الرقم الهيدروجيني | 8.5 – 9.5 (محلول 1%) |
سلامة ومخاطر بيكربونات البوتاسيوم
يعتبر KHCO3 آمنًا بشكل عام عند استخدامه وفقًا للتعليمات. ومع ذلك، فإنه قد يسبب تهيج الجلد والعين ويجب التعامل معه بحذر. ويمكن أن يكون ضارًا أيضًا إذا تم تناوله بكميات كبيرة. استنشاق الغبار قد يسبب تهيج الجهاز التنفسي. بالإضافة إلى ذلك، يمكن أن يتفاعل مع الأحماض القوية لإطلاق ثاني أكسيد الكربون، والذي يمكن أن يكون خطيرًا. عند استخدام KHCO3، من المهم اتباع إجراءات السلامة وارتداء معدات الحماية المناسبة. في حالة ابتلاعه، اطلب العناية الطبية على الفور. في حالة ملامسة الجلد أو العينين، اغسل المنطقة المصابة جيدًا بالماء واطلب العناية الطبية في حالة استمرار التهيج.
| رموز الخطر | لا أحد |
| وصف الأمان | ضار إذا ابتلع، يسبب تهيج الجلد والعين. تجنب الاستنشاق. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 2987 |
| رمز النظام المنسق | 2836.30.00 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (الفئران، عن طريق الفم): 6400 ملغم/كغم |
طرق تصنيع بيكربونات البوتاسيوم
في وجود الماء، يتفاعل ثاني أكسيد الكربون مع كربونات البوتاسيوم لتصنيع KHCO3.
يحدث التفاعل على النحو التالي:
K2CO3 + CO2 + H2O → 2KHCO3
هناك طريقة أخرى وهي تفاعل هيدروكسيد البوتاسيوم مع ثاني أكسيد الكربون:
كوه + CO2 → KHCO3
ويمكن بعد ذلك تنقية KHCO3 الناتج عن طريق إعادة بلورته من الماء. يعتمد ناتج التفاعل على نقاء المواد الخام وظروف التفاعل.
لإنتاج KHCO3، يمكن تفاعل كلوريد البوتاسيوم مع بيكربونات الأمونيوم، ثم معالجته بثاني أكسيد الكربون.
NH4HCO3 + بوكل → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
تتميز هذه الطريقة باستخدام مواد خام غير مكلفة ولا تنتج أي منتجات ثانوية خطيرة.
استخدامات بيكربونات البوتاسيوم
لدى KHCO3 مجموعة واسعة من الاستخدامات في مختلف الصناعات والتطبيقات. فيما يلي بعض الاستخدامات الأكثر شيوعًا:
- صناعة المواد الغذائية: يستخدم كمادة تاركة في المخبوزات، مثل الكعك والبسكويت والخبز، لمساعدتها على الارتفاع.
- الزراعة: يستخدم كمبيد فطري لمكافحة أمراض النباتات الفطرية، مثل البياض الدقيقي.
- المستحضرات الصيدلانية: يستخدم في مضادات الحموضة لتحييد حمض المعدة وعلاج عسر الهضم وحرقة المعدة.
- طفايات الحريق: تستخدم في طفايات الحريق كعامل كيميائي جاف لإطفاء حرائق الصنف B وC.
- التطبيقات المخبرية: يستخدم في العديد من التطبيقات المخبرية، مثل تخزين الرقم الهيدروجيني وزراعة الخلايا.
- منتجات العناية الشخصية: تستخدم في معاجين الأسنان كمواد كاشطة خفيفة وفي مزيلات العرق للمساعدة في السيطرة على الروائح.
- معالجة المياه: يستخدم في معالجة المياه لضبط مستوى الرقم الهيدروجيني وإزالة المعادن الثقيلة والشوائب الأخرى.
أسئلة:
س: ما هو بيكربونات البوتاسيوم؟
ج: KHCO3 هو مسحوق أبيض عديم الرائحة يستخدم عادة في مختلف الصناعات، مثل الأغذية والزراعة والأدوية. له الصيغة الكيميائية KHCO3 وهو ملح يتكون من كاتيون البوتاسيوم وأنيون البيكربونات وجزيئات الماء.
س: هل تتحول البيكربونات الموجودة في أقراص البوتاسيوم الفوارة إلى ثاني أكسيد الكربون؟
ج: نعم، عندما تذوب أقراص البوتاسيوم الفوارة في الماء، تتفاعل البيكربونات الموجودة في القرص مع حامض الستريك ليطلق ثاني أكسيد الكربون. ينتج عن هذا التفاعل الأزيز والفقاعات المميزة المرتبطة بالأقراص الفوارة.
س: ماذا يحدث بعد إضافة بيكربونات البوتاسيوم إلى النبيذ؟
الى: إن إضافة KHCO3 إلى النبيذ يقلل من حموضة النبيذ عن طريق التفاعل مع الحمض الزائد الموجود. يستخدم صانعو النبيذ عادة هذه العملية، التي تسمى إزالة الحموضة، لتحسين طعم وجودة النبيذ.
س: أين يمكن شراء بيكربونات البوتاسيوم؟
ج: يمكن شراء KHCO3 من مختلف موردي المواد الكيميائية والأسواق عبر الإنترنت ومتاجر الإمدادات الزراعية. كما أنه متوفر بشكل شائع في متاجر الأغذية الصحية وأسواق الأغذية الصحية.
س: ما اسم المركب الذي صيغته KHCO3؟
ج: المركب الذي له الصيغة KHCO3 يسمى بيكربونات البوتاسيوم.
س: ما الذي تم فعله في التجربة للتأكد من تفاعل كل KHCO3؟
ج: في تجربة التأكد من تفاعل كل KHCO3، تمت إضافة الحمض الزائد إلى خليط التفاعل واستمر التفاعل حتى توقف إنتاج الغاز. يشير غياب الغاز إلى أن كل KHCO3 قد تفاعل مع الحمض.
س: ماذا يحدث إذا قمت بتسخين KHCO3؟
ج: عند تسخين KHCO3 فإنه يتحلل ليشكل كربونات البوتاسيوم (K2CO3) والماء وثاني أكسيد الكربون. يحدث هذا التفاعل على النحو التالي: 2KHCO3 → K2CO3 + H2O + CO2.
