بيركلورات الكالسيوم (Ca(ClO4)2) هو مركب كيميائي له العديد من الاستخدامات، بما في ذلك في الألعاب النارية ووقود الصواريخ. وهو قابل للذوبان جدًا في الماء ويمكن استخدامه أيضًا كعامل تجفيف.
| اسم الأيوباك | بيركلورات الكالسيوم |
| الصيغة الجزيئية | الكالسيوم (ClO4)2 |
| CAS رقم | 13477-36-6 |
| المرادفات | كالسيوفوس، ملح الكالسيوم لحمض البيركلوريك، ثنائي بيركلورات الكالسيوم، بيركلورات الكالسيوم (II)، UN1459 |
| إنتشي | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
خصائص بيركلورات الكالسيوم
صيغة بيركلورات الكالسيوم
صيغة بيركلورات الكالسيوم هي Ca(ClO4)2. وهو يتألف من أيون Ca2+ واحد وأيونات ClO4-. أيون الكالسيوم لديه شحنة موجبة 2+ وكل أيون ClO4- لديه شحنة سالبة 1-. تستخدم هذه الصيغة لتمثيل التركيب الكيميائي لبيركلورات الكالسيوم.
بيركلورات الكالسيوم الكتلة المولية
الكتلة المولية لـ Ca(ClO4)2 هي 238.98 جم/مول. تمثل هذه القيمة كتلة مول واحد من Ca(ClO4)2، الذي يحتوي على عدد أفوجادرو من الجزيئات. الكتلة المولية مهمة في تحديد كمية Ca(ClO4)2 اللازمة في تفاعل معين.
نقطة غليان بيركلورات الكالسيوم
Ca(ClO4)2 ليس له نقطة غليان لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند تسخينه، فإنه يتحلل إلى كلوريد الكالسيوم وغاز الأكسجين وغاز الكلور. تفاعل التحلل هذا طارد للحرارة بقوة، ويطلق كمية كبيرة من الحرارة.
نقطة انصهار بيركلورات الكالسيوم
درجة انصهار Ca(ClO4)2 هي 200 درجة مئوية. درجة الحرارة هذه هي النقطة التي يتحول عندها Ca(ClO4)2 الصلب إلى الحالة السائلة. تعتبر نقطة الانصهار مهمة في تحديد الخصائص الفيزيائية لـ Ca(ClO4)2، مثل إمكانية استخدامه كعامل تجفيف.
كثافة بيركلورات الكالسيوم جم/مل
تبلغ كثافة Ca(ClO4)2 2.505 جم/مل. تمثل هذه القيمة مقدار الكتلة لكل وحدة حجم من Ca(ClO4)2. كثافة Ca(ClO4)2 أكبر من كثافة الماء، مما يعني أنه يغوص في الماء.
الوزن الجزيئي لبيركلورات الكالسيوم
الوزن الجزيئي لـ Ca(ClO4)2 هو 238.98 جم/مول. تمثل هذه القيمة مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء Ca(ClO4)2. الوزن الجزيئي مهم في تحديد كمية Ca(ClO4)2 اللازمة في تفاعل معين.
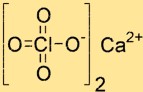
هيكل بيركلورات الكالسيوم
يتكون هيكل Ca(ClO4)2 من أيون Ca2+ واحد وأيونات ClO4-. يقع أيون Ca2+ في وسط الهيكل ويحيط به أربع ذرات أكسجين تنشأ من أيونين ClO4-. أيونات ClO4- رباعية السطوح وترتبط بأيون الكالسيوم بواسطة ذرات الأكسجين.
ذوبان بيركلورات الكالسيوم
Ca(ClO4)2 قابل للذوبان بدرجة عالية في الماء، مع ذوبان 121 جم/100 مل عند 20 درجة مئوية. هذه القابلية للذوبان تجعله مفيدًا كعامل تجفيف لأنه يمكنه امتصاص الماء من المناطق المحيطة به. ومع ذلك، فهو غير قابل للذوبان في المذيبات العضوية مثل الإيثانول والأسيتون.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2,505 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 238.98 جرام/مول |
| كثافة | 2,505 جم/مل |
| نقطة الانصهار | 200 درجة مئوية |
| نقطة الغليان | يتحلل قبل نقطة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 121 جم/100 مل عند 20 درجة مئوية |
| الذوبان | غير قابلة للذوبان في المذيبات العضوية |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر بيركلورات الكالسيوم
يشكل Ca(ClO4)2 العديد من مخاطر السلامة ويجب اتخاذ تدابير السلامة المناسبة عند التعامل معه. وهو مادة مؤكسدة قوية يمكن أن تتفاعل مع المواد القابلة للاشتعال، مما يتسبب في نشوب حريق أو انفجار. استنشاق غباره أو بخاره قد يسبب تهيج الجهاز التنفسي وملامسته للجلد قد يسبب تهيجًا أو حروقًا. كما أنه ضار إذا تم تناوله، مما يسبب تهيج أو تآكل الجهاز الهضمي. يجب ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع Ca(ClO4)2 ويجب تخزينها بعيدًا عن المواد القابلة للاشتعال والمواد غير المتوافقة.
| رموز الخطر | عامل مؤكسد، ضار إذا ابتلع |
| وصف الأمان | الابتعاد عن المواد القابلة للاشتعال والمواد غير المتوافقة. ارتداء القفازات والنظارات الواقية. تجنب استنشاق الغبار أو الأبخرة. في حالة ملامسة المنتج، اغسله بكمية كبيرة من الماء واستشر الطبيب إذا لزم الأمر. |
| أرقام تعريف الأمم المتحدة | UN1502 |
| رمز النظام المنسق | 2829.9000 |
| فئة الخطر | 5.1 – المواد المؤكسدة |
| مجموعة التعبئة | ثانيا |
| تسمم | ضار في حالة ابتلاعه، ومهيج للجلد والجهاز التنفسي |
طرق تصنيع بيركلورات الكالسيوم
يمكن تصنيع Ca(ClO4)2 عن طريق تفاعل هيدروكسيد الكالسيوم مع حمض البيركلوريك أو بيركلورات الأمونيوم.
تتضمن إحدى الطرق تفاعل كربونات الكالسيوم مع حمض البيركلوريك في وعاء التفاعل، يليه ترشيح وتبخير المحلول للحصول على المنتج الصلب.
تتضمن الطريقة الأخرى تفاعل أكسيد الكالسيوم مع محلول مائي من حمض البيركلوريك، يليه ترشيح وتجفيف المنتج الناتج.
في بعض الحالات، يمكن تصنيع Ca(ClO4)2 عن طريق تفاعل كلوريد الكالسيوم مع بيركلورات الصوديوم في وعاء التفاعل. يمكن ترشيح المنتج وتجفيفه للحصول على Ca(ClO4)2 بعد التفاعل.
هناك طريقة شائعة أخرى لتصنيع Ca(ClO4)2 تتضمن تفاعل كلوريد الكالسيوم مع بيركلورات الأمونيوم، والذي ينتج Ca(ClO4)2 وكلوريد الأمونيوم كمنتجات ثانوية. تفضل تطبيقات الألعاب النارية هذه الطريقة نظرًا لقدرتها على إنتاج Ca(ClO4)2 بدرجة نقاء عالية.
ومن المهم ملاحظة أنه عند العمل بحمض البيركلوريك يجب اتخاذ احتياطات السلامة المناسبة، فهو عامل مؤكسد قوي يمكن أن يتفاعل مع المواد العضوية ويسبب حريقاً أو انفجاراً.
استخدامات بيركلورات الكالسيوم
Ca(ClO4)2 له العديد من الاستخدامات في مختلف الصناعات والتطبيقات. بعض استخدامات Ca(ClO4)2 هي:
- الألعاب النارية: يشيع استخدامها في الألعاب النارية كعامل مؤكسد بسبب محتواها العالي من الأكسجين واستقرارها.
- الأسمدة: يستخدم في الأسمدة لتزويد النباتات بالكالسيوم والكلور، وهما من العناصر الغذائية الأساسية لنموها.
- وقود الصواريخ: يستخدم كأحد مكونات وقود الصواريخ بسبب محتواه العالي من الأكسجين وثباته.
- تكرير النفط: يستخدم في صناعة النفط لإزالة مركبات الكبريت من النفط الخام والمواد الهيدروكربونية الأخرى.
- منفاخ الوسائد الهوائية: يستخدم في صناعة منفاخ الوسائد الهوائية نظراً لقدرتها على التحلل السريع وتوليد الغازات.
- المشاعل: تستخدم في صناعة المشاعل بسبب محتواها العالي من الأكسجين وثباتها.
- معالجة الأسطح المعدنية: يستخدم في معالجة الأسطح المعدنية لإزالة الصدأ والشوائب الأخرى.
- التطبيقات المخبرية: يستخدم في العديد من التطبيقات المخبرية، مثل تحضير حمض البيركلوريك وكعامل تجفيف.
أسئلة:
س: ما هي صيغة بيركلورات الكالسيوم؟
ج: الكالسيوم (ClO4)2.
س: هل بيركلورات الكالسيوم أيونية أم تساهمية؟
ج: Ca(ClO4)2 مركب أيوني لأنه يتكون من كاتيونات الكالسيوم (Ca2+) وأنيونات بيركلورات (ClO4-).
س: كيف أتخلص من بيركلورات الكالسيوم؟
ج: يمكن إزالة Ca(ClO4)2 بغسل المنطقة المصابة بالماء ثم معادلة أي آثار متبقية للمركب ذات قاعدة ضعيفة مثل بيكربونات الصوديوم.
س: هل بيركلورات الكالسيوم قابلة للذوبان؟
ج: نعم، Ca(ClO4)2 قابل للذوبان في الماء والمذيبات القطبية الأخرى. تبلغ قابليته للذوبان في الماء حوالي 120 جم لكل 100 مل من الماء في درجة حرارة الغرفة.
س: ما هي التفاعلات التي تنتجها بيركلورات الكالسيوم والماء؟
ج: لا يتفاعل Ca(ClO4)2 والماء مع بعضهما البعض في الظروف العادية.
س: ما عدد ذرات الكلور الموجودة في 0.650 مول من Ca(ClO4)2؟
ج: يوجد 5.88 × 10^23 ذرة كلور في 0.650 مول من Ca(ClO4)2.
س: ما الكتلة المولية لـ Ca(ClO4)2؟
ج: الكتلة المولية لـ Ca(ClO4)2 هي 238.98 جم/مول.
س: ما هو معامل نشاط H في محلول يحتوي على 0.073 M HCl و 0.0090 M Ca(ClO4)2؟
ج: إن معامل نشاط H في محلول يحتوي على 0.073 M HCl و 0.0090 M Ca(ClO4)2 يعتمد على درجة الحرارة وعوامل أخرى. ويمكن حسابه باستخدام النماذج الديناميكية الحرارية والبيانات التجريبية.
س: ما عدد المولات الموجودة في 26.0 جرامًا من Ca(ClO4)2؟
ج: يوجد 0.109 مول من Ca(ClO4)2 في 26.0 جرام من المركب.
