بيركلورات البوتاسيوم (KClO4) هو مركب يحتوي على البوتاسيوم والكلور والأكسجين. يستخدم عادة في الألعاب النارية والمتفجرات بسبب خصائصه المؤكسدة.
| اسم الأيوباك | بيركلورات البوتاسيوم |
| الصيغة الجزيئية | كلوريد البوتاسيوم4 |
| CAS رقم | 7778-74-7 |
| المرادفات | بيركال K، بيركلورات البوتاس، كلورات البوتاسيوم (VII)، رقم الأمم المتحدة 1489 |
| إنتشي | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
خصائص بيركلورات البوتاسيوم
صيغة بيركلورات البوتاسيوم
بيركلورات البوتاسيوم لها الصيغة الكيميائية KClO4، مما يدل على أنها تحتوي على ذرة بوتاسيوم واحدة، وذرة كلور واحدة، وأربع ذرات أكسجين. المركب عبارة عن ملح غير عضوي شديد الذوبان في الماء، مما يجعله مؤكسدًا مفيدًا في العديد من التطبيقات.
بيركلورات البوتاسيوم الكتلة المولية
يتم حساب الكتلة المولية لـ KClO4 عن طريق إضافة الكتل الذرية للعناصر المكونة للمركب. الكتل الذرية للبوتاسيوم والكلور والأكسجين هي 39.10 جم/مول، 35.45 جم/مول، و16.00 جم/مول، على التوالي. إذن، الكتلة المولية لـ KClO4 هي 138.55 جم/مول.
نقطة غليان بيركلورات البوتاسيوم
ليس لدى KClO4 نقطة غليان محددة لأنه يتحلل قبل الوصول إلى نقطة الغليان. عند تسخينه إلى درجات حرارة عالية، يتحلل KClO4 إلى كلوريد البوتاسيوم وغاز الأكسجين. ومع ذلك، فقد لوحظ أن المركب يمكن أن يتسامى عند درجات حرارة تتراوح بين 400 إلى 500 درجة مئوية.
نقطة انصهار بيركلورات البوتاسيوم
تبلغ نقطة انصهار KClO4 حوالي 610 درجة مئوية. عند درجة الحرارة هذه، يتحول المركب الصلب إلى الحالة السائلة. نقطة الانصهار العالية لـ KClO4 تجعله مناسبًا للاستخدام في التطبيقات الصناعية المختلفة.
كثافة بيركلورات البوتاسيوم جم/مل
تبلغ كثافة KClO4 حوالي 2.52 جم/سم مكعب عند درجة حرارة الغرفة. يشير هذا إلى أن المركب أكثر كثافة من الماء الذي تبلغ كثافته 1 جم/سم3. الكثافة العالية لـ KClO4 تجعله عامل مؤكسد فعال في الألعاب النارية.
الوزن الجزيئي لبيركلورات البوتاسيوم
الوزن الجزيئي لـ KClO4 هو 138.55 جم/مول. يتم تحديد هذه القيمة عن طريق إضافة الكتل الذرية للعناصر المكونة للمركب. الوزن الجزيئي لـ KClO4 مفيد في تحديد كتلة المركب اللازم لتفاعل أو عملية معينة.
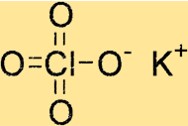
هيكل بيركلورات البوتاسيوم
يحتوي KClO4 على بنية بلورية رباعية الأضلاع، مما يعني أن له تناظرًا بأربعة أضعاف حول محوره c. تتكون الشبكة البلورية للمركب من أيونات البوتاسيوم، وأيونات الكلور، وأيونات الأكسجين، والتي ترتبط ببعضها البعض بواسطة روابط أيونية.
ذوبان بيركلورات البوتاسيوم
KClO4 قابل للذوبان بدرجة عالية في الماء، مع قابلية ذوبان تبلغ حوالي 4.5 جم / مل في درجة حرارة الغرفة. المركب قابل للذوبان أيضًا في المذيبات القطبية الأخرى مثل الإيثانول والأسيتون. ومع ذلك، فهو غير قابل للذوبان في المذيبات غير القطبية مثل البنزين والكلوروفورم. تعد قابلية ذوبان KClO4 عاملاً مهمًا في استخدامه كمؤكسد في التطبيقات الصناعية المختلفة.
| مظهر | مادة صلبة بلورية بيضاء |
| كثافة محددة | 2.52 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 138.55 جرام/مول |
| كثافة | 2.52 جم/سم3 |
| نقطة الانصهار | 610 درجة مئوية |
| نقطة الغليان | يتحلل قبل نقطة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 4.5 جم/مل عند 25 درجة مئوية |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون، غير قابل للذوبان في البنزين والكلوروفورم |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | حيادي |
سلامة ومخاطر بيركلورات البوتاسيوم
يمكن أن يشكل KClO4 مخاطر على السلامة إذا لم يتم التعامل معه بشكل صحيح. المركب مؤكسد قوي ويمكن أن يتفاعل مع المواد القابلة للاحتراق ويسبب حرائق أو انفجارات. قد يؤدي أيضًا استنشاق غبار أو بخار KClO4 إلى تهيج الجهاز التنفسي. التعرض لفترات طويلة للمركب قد يؤدي إلى تهيج الجلد أو التهاب الجلد. عند التعامل مع KClO4، من المهم استخدام معدات الحماية الشخصية المناسبة مثل القفازات ونظارات السلامة وأجهزة التنفس. ويجب أيضًا تخزين المركب في منطقة باردة وجافة، بعيدًا عن المواد غير المتوافقة ومصادر الحرارة والاشتعال.
| رموز الخطر | مؤكسد |
| وصف الأمان | الابتعاد عن المواد القابلة للاحتراق. ارتداء معدات الحماية الشخصية المناسبة. تجنب استنشاق الغبار أو الأبخرة. |
| أرقام تعريف الأمم المتحدة | UN1489 |
| رمز النظام المنسق | 2829.90.90 |
| فئة الخطر | 5.1 – المواد المؤكسدة |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب تهيج الجلد أو التهاب الجلد مع التعرض لفترة طويلة. ابتلاع أو استنشاق المركب قد يسبب تهيج الجهاز التنفسي. |
طرق تصنيع بيركلورات البوتاسيوم
يمكن تصنيع KClO4 بطرق مختلفة.
الطريقة الشائعة هي تفاعل كلورات البوتاسيوم مع بيركلورات الباريوم. ينتج عن التفاعل KClO4 وكلوريد الباريوم كمنتج ثانوي، والذي يمكن ترشيحه.
تتضمن الطريقة الأخرى تفاعل كلورات البوتاسيوم مع حمض الهيدروكلوريك وكلوريد الصوديوم. وينتج عن التفاعل KClO4 وكلورات الصوديوم، والتي يمكن فصلها عن طريق التبلور.
يمكن للتفاعل بين هيدروكسيد البوتاسيوم وبيركلورات الأمونيوم أيضًا تصنيع KClO4. وينتج عن التفاعل KClO4 وهيدروكسيد الأمونيوم، اللذين يمكن فصلهما عن طريق الترشيح.
تتضمن الطريقة الأخرى تفاعل كلوريد البوتاسيوم مع بيركلورات الصوديوم في وجود محفز. وينتج عن التفاعل KClO4 وكلوريد الصوديوم، اللذين يمكن فصلهما عن طريق التبلور.
استخدامات بيركلورات البوتاسيوم
KClO4 له استخدامات مختلفة في صناعات مختلفة. بعض استخداماته الشائعة هي:
- الألعاب النارية: عامل مؤكسد شائع في صناعة الألعاب النارية. يستخدم في صناعة الألعاب النارية والمشاعل وغيرها من أنواع المتفجرات.
- مراوح الصواريخ: تستخدم كمادة مؤكسدة في صناعة وقود الصواريخ. يشيع استخدامها في معززات الصواريخ الصلبة وعمليات إطلاق المكوك الفضائي.
- بادئ الوسائد الهوائية: يستخدم كبادئ في صناعة الوسائد الهوائية. ولنشر الوسادة الهوائية، يتم إرسال شحنة كهربائية عبر سلك مطلي بمادة KClO4. ويؤدي هذا إلى تفاعل ينتج عنه غاز النيتروجين، الذي يؤدي إلى نفخ الوسادة الهوائية.
- أعواد الثقاب: تستخدم في إنتاج أعواد الثقاب الآمنة. لإنتاج مركب قابل للاحتراق يشتعل عند اصطدامه بسطح خشن، يتم خلطه مع كبريتيد الأنتيمون والكبريت.
- الطلاء الكهربائي: يستخدم في صناعة الطلاء الكهربائي كأحد مكونات الإلكتروليتات المستخدمة في طلاء المعادن بالكهرباء.
- الطب: يستخدم في علاج أمراض الغدة الدرقية مثل فرط نشاط الغدة الدرقية. ومع ذلك، انخفض استخدامه في الطب بسبب مخاوف تتعلق بالسلامة.
- الكيمياء التحليلية: تستخدم أيضًا ككاشف في الكيمياء التحليلية لتقدير بعض المواد.
أسئلة:
س: ما أنواع الروابط الموجودة في جزيء بيركلورات البوتاسيوم؟
ج: يحتوي KClO4 على روابط أيونية وتساهمية. يتم ربط أيون K+ وأيون ClO4- معًا بواسطة روابط أيونية، بينما يحتوي أيون البيركلورات نفسه على روابط تساهمية وأيونية.
س: ما هي صيغة بيركلورات البوتاسيوم؟
ج: كلوريد البوتاسيوم4.
س: هل بيركلورات البوتاسيوم مائي؟
ج: يمكن أن يذوب KClO4 في الماء، مما يجعله مائيًا في ظل ظروف معينة.
س: ما هي استخدامات بيركلورات البوتاسيوم؟
ج: لدى KClO4 تطبيقات مختلفة، بما في ذلك الألعاب النارية ومعززات الصواريخ ونافخات الوسائد الهوائية. كما أنه يستخدم في الكيمياء التحليلية ككاشف وعامل مؤكسد.
س: كيفية صنع مسحوق فلاش بدون بيركلورات البوتاسيوم؟
ج: يمكن صنع مسحوق فلاش بدون KClO4 باستخدام مواد مؤكسدة بديلة، مثل بيركلورات الأمونيوم، أو بيركلورات الصوديوم، أو بيروكسيد الباريوم.
س: ما هي حالة الأكسدة لذرة الكلور الفردية في KClO4؟
ج: حالة الأكسدة لذرة الكلور الفردية في KClO4 هي +7.
س: هل KClO4 قابل للذوبان في الماء؟
ج: نعم، KClO4 قابل للذوبان في الماء.
س: هل KClO4 حمض أم قاعدة؟
ج: KClO4 ليس حمضاً ولا قاعدة. وهو ملح يتكون من معدن (البوتاسيوم) وأيون متعدد الذرات (بيركلورات).
