بروميد المغنيسيوم (MgBr2) هو مركب يتكون من Mg وBr، ويستخدم عادة كمحفز في تفاعلات التخليق العضوي وكمهدئ في الطب.
| اسم الأيوباك | بروميد المغنيسيوم |
| الصيغة الجزيئية | مجبر2 |
| CAS رقم | 7789-48-2 |
| المرادفات | ثنائي بروميد المغنيسيوم، UN1913، بروموماجنسيت، بروماتوم المغنيسيوم، بروميد المغنيسيوم، بروميد المغنيسيوم |
| إنتشي | InChI=1S/2BrH.Mg/h2*1H;/q;;+2/p-2 |
خصائص بروميد المغنيسيوم
صيغة بروميد المغنيسيوم
الصيغة الكيميائية لبروميد المغنيسيوم هي MgBr2. يشير هذا إلى أن MgBr2 يتكون من أيون Mg+2 واحد وأيونات Br-. تمثل الصيغة نسبة الذرات في الجزيء وتلعب دورا حيويا في تحديد خصائص المركب. تشير صيغة بروميد المغنيسيوم إلى أنه مركب أيوني ذو درجة انصهار وغليان عالية ورابطة أيونية قوية بين أيونات Mg+2 وأيونات البريون.
بروميد المغنيسيوم الكتلة المولية
الكتلة المولية لـ MgBr2 هي 184.113 جم/مول. وهو مجموع الكتل الذرية للمغنيسيوم وذرتين من البروم. تعد الكتلة المولية عاملاً حاسماً في الحسابات الكيميائية لأنها تساعد في تحديد عدد مولات المادة في كمية معينة من العينة. تلعب الكتلة المولية لـ MgBr2 دورًا حيويًا في تحديد كمية المركب اللازمة للتفاعلات الكيميائية.
نقطة غليان بروميد المغنيسيوم
تبلغ درجة غليان MgBr2 1,204 درجة مئوية أو 2,199 درجة فهرنهايت. نقطة غليان المركب هي درجة الحرارة التي يساوي عندها ضغط بخاره الضغط الجوي. تشير نقطة الغليان العالية لـ MgBr2 إلى أنه مركب مستقر قادر على تحمل درجات الحرارة العالية دون تحلل. هذه الخاصية تجعله مفيدًا في تطبيقات درجات الحرارة المرتفعة مثل تفاعلات المعادن والتخليق العضوي.
نقطة انصهار بروميد المغنيسيوم
تبلغ درجة انصهار MgBr2 714 درجة مئوية أو 1317 درجة فهرنهايت. نقطة انصهار المركب هي درجة الحرارة التي يتحول عندها من الحالة الصلبة إلى الحالة السائلة. تشير نقطة الانصهار العالية لـ MgBr2 إلى أنه مركب مستقر ذو قوى جزيئية قوية. هذه الخاصية تجعله مفيدًا ككاشف في التفاعلات الكيميائية عند درجات حرارة عالية.
كثافة بروميد المغنيسيوم جم/مل
تبلغ كثافة MgBr2 3.72 جم/مل. الكثافة هي مقياس لكمية الكتلة لكل وحدة حجم من المادة. تشير الكثافة العالية لـ MgBr2 إلى أنه مركب ثقيل يمكن أن يغوص في الماء. هذه الخاصية تجعله مفيدًا في تطبيقات مختلفة مثل التخليق غير العضوي وكمهدئ في الطب.
بروميد المغنيسيوم الوزن الجزيئي
الوزن الجزيئي لـ MgBr2 هو 184.113 جم/مول. وهو مجموع الكتل الذرية للمغنيسيوم وذرتين من البروم. يلعب الوزن الجزيئي دورًا حاسمًا في تحديد الخواص الكيميائية والفيزيائية للمركب. يؤثر الوزن الجزيئي لـ MgBr2 على تفاعله وقابليته للذوبان في المذيبات المختلفة.
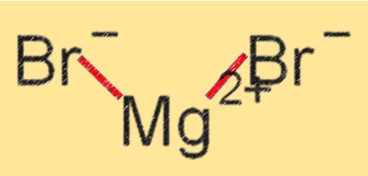
هيكل بروميد المغنيسيوم
يحتوي MgBr2 على بنية شبكية بلورية تحتوي على أيونات Mg+2 وBr- مرتبطة معًا بواسطة روابط أيونية. وهي مادة صلبة بلورية بيضاء شديدة الذوبان في الماء والمذيبات القطبية الأخرى. يساهم هيكل الشبكة البلورية لـ MgBr2 في ارتفاع درجات انصهاره وغليانه، فضلاً عن ثباته في التفاعلات الكيميائية المختلفة.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 3.72 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 184,113 جرام/مول |
| كثافة | 3.72 جم/مل |
| نقطة الانصهار | 714 درجة مئوية (1,317 درجة فهرنهايت) |
| نقطة الغليان | 1204 درجة مئوية (2199 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والإيثانول والأسيتون والأثير |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | حيادي |
سلامة ومخاطر بروميد المغنيسيوم
يعتبر MgBr2 آمنًا بشكل عام عند التعامل معه بشكل صحيح. ومع ذلك، مثل أي مركب كيميائي، فإنه يمكن أن يشكل مخاطر إذا لم يتم التعامل معه بعناية. يعتبر MgBr2 مادة أكالة ويمكن أن يسبب تهيجًا شديدًا في الجلد والعين. قد يؤدي استنشاق غبار أو أبخرة MgBr2 إلى تهيج الجهاز التنفسي. من المهم ارتداء الملابس الواقية ومعدات التنفس عند التعامل مع MgBr2. يمكن أن يتفاعل MgBr2 أيضًا بعنف مع مواد كيميائية معينة، مثل الماء أو الأحماض، منتجًا غاز بروميد الهيدروجين. لذلك، من الضروري تخزين ومعالجة MgBr2 بعيدًا عن المواد غير المتوافقة وفي منطقة جيدة التهوية.
| رموز الخطر | تآكل |
| وصف الأمان | تجنب ملامسة الجلد والعينين. ارتداء الملابس الواقية ومعدات التنفس. التعامل مع وتخزين بعيدا عن المواد غير المتوافقة. |
| أرقام تعريف الأمم المتحدة | UN2920 |
| رمز النظام المنسق | 2827.59.90 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثانيا |
| تسمم | سمية منخفضة إذا تم التعامل معها بشكل صحيح. قد يسبب تهيج الجلد والعين. استنشاق الغبار أو الأبخرة قد يسبب تهيج الجهاز التنفسي. |
طرق تخليق بروميد المغنيسيوم
يمكن تصنيع MgBr2 بعدة طرق.
الطريقة الشائعة هي التفاعل بين المغنيسيوم المعدني وغاز بروميد الهيدروجين . تتضمن هذه العملية تمرير غاز بروميد الهيدروجين فوق معدن الماغنيسيوم، لإنتاج MgBr2 وغاز الهيدروجين.
طريقة أخرى هي التفاعل بين أكسيد المغنيسيوم أو هيدروكسيد المغنيسيوم وحمض الهيدروبروميك . تنتج هذه العملية MgBr2 والماء كمنتجات.
بالإضافة إلى ذلك، يمكن تصنيع MgBr2 عن طريق التفاعل بين كربونات المغنيسيوم وحمض الهيدروبروميك ، أو عن طريق التفاعل بين كبريتات المغنيسيوم وNaBr.
تتضمن هذه الطرق خلط الكواشف والسماح بمواصلة التفاعل، مما يؤدي إلى تكوين MgBr2.
استخدامات بروميد المغنيسيوم
MgBr2 له استخدامات مختلفة في مختلف الصناعات. فيما يلي بعض تطبيقاته الشائعة:
- في التخليق العضوي: يستخدم كمحفز لحمض لويس في تفاعلات التخليق العضوي، مثل تفاعل جرينارد، الذي يتضمن تكوين روابط كربون-كربون.
- في إنتاج مثبطات اللهب: تعتمد مثبطات اللهب، التي تجعل المواد أقل قابلية للاشتعال، عليها كعنصر حاسم في إنتاجها.
- في صناعة النفط والغاز: يستخدم كمائع استكمال في آبار النفط والغاز، مما يساعد على الحفاظ على الضغط ويمنع انهيار الآبار.
- في المستحضرات الصيدلانية: يستخدم كمادة فعالة في بعض المستحضرات الصيدلانية، مثل المهدئات ومضادات الاختلاج.
- في الكيمياء الكهربائية: يستخدم كإلكتروليت في البطاريات والأجهزة الكهروكيميائية الأخرى.
- في إنتاج المعادن: يستخدم كصهيرة في إنتاج بعض المعادن مثل الألومنيوم والتيتانيوم.
- في الكيمياء التحليلية: يستخدم ككاشف في الكيمياء التحليلية لتقدير العناصر المختلفة مثل البورون والفلورايد.
أسئلة:
س: ما هي الصيغة الكيميائية لبروميد المغنيسيوم؟
ج: الصيغة الكيميائية لبروميد المغنيسيوم هي MgBr2.
س: هل بروميد المغنيسيوم أيوني أم تساهمي؟
ج: MgBr2 مركب أيوني.
س: ما هي صيغة بروميد المغنيسيوم؟
ج: صيغة بروميد المغنيسيوم هي MgBr2.
س: هل بروميد المغنيسيوم قابل للذوبان في الماء؟
ج: نعم، MgBr2 قابل للذوبان في الماء. وهو شديد الذوبان في الماء ويمكن أن يذوب ليشكل محلولًا واضحًا عديم اللون.
س: ما هي صيغة بروميد المغنيسيوم؟
ج: صيغة بروميد المغنيسيوم هي MgBr2.
