بروميد الكالسيوم مركب كيميائي له الصيغة CaBr2. وهي مادة صلبة بيضاء عديمة الرائحة وقابلة للذوبان، وتستخدم في صناعات مختلفة كمصدر لأيونات البروميد.
| اسم الأيوباك | بروميد الكالسيوم |
| الصيغة الجزيئية | CaBr2 |
| CAS رقم | 7789-41-5 |
| المرادفات | ثنائي بروميد الكالسيوم؛ بروموكالسيوم |
| إنتشي | InChI=1S/Ca.2BrH/h;2*1H/q+2;;/p-2 |
خصائص بروميد الكالسيوم
صيغة بروميد الكالسيوم
الصيغة الكيميائية لبروميد الكالسيوم هي CaBr2. تشير هذه الصيغة إلى أن أيون الكالسيوم يرتبط بأيوني بروميد بواسطة روابط أيونية. تمثل صيغة المركب أنواع وعدد الذرات الموجودة في الجزيء أو وحدة صيغة المركب.
بروميد الكالسيوم الكتلة المولية
الكتلة المولية لـ CaBr2 هي 199.89 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الكتل الذرية لذرة كالسيوم واحدة (40.08 جم / مول) وذرتين من البروم (79.90 جم / مول لكل منهما). الكتلة المولية هي خاصية مهمة لأي مركب كيميائي لأنها تحدد كمية المادة الموجودة في مول واحد من المركب.
نقطة غليان بروميد الكالسيوم
نقطة غليان CaBr2 هي 1193 درجة مئوية (2179 درجة فهرنهايت). يتميز CaBr2 بنقطة غليان عالية بسبب طبيعته الأيونية. تتمتع المركبات الأيونية بقوى كهروستاتيكية قوية بين أيونها الموجبة والسالبة الشحنة. تتطلب هذه القوى الكثير من الطاقة لتتحلل، مما يؤدي إلى ارتفاع نقطة الغليان.
نقطة انصهار بروميد الكالسيوم
نقطة انصهار CaBr2 هي 730 درجة مئوية (1346 درجة فهرنهايت). نقطة انصهار المركب هي درجة الحرارة التي يتحول عندها من الحالة الصلبة إلى الحالة السائلة. يتمتع CaBr2 بنقطة انصهار عالية نسبيًا بسبب طبيعته الأيونية. وتتطلب القوى الكهروستاتيكية القوية بين أيوناتها الكثير من الطاقة للتغلب عليها، مما يؤدي إلى ارتفاع نقطة الانصهار.
كثافة بروميد الكالسيوم جم/مل
تبلغ كثافة CaBr2 3.353 جم/مل. الكثافة هي كتلة المادة لكل وحدة حجم. ترجع الكثافة العالية لـ CaBr2 إلى طبيعته الأيونية والترتيب المحكم لأيوناته.
الوزن الجزيئي لبروميد الكالسيوم
الوزن الجزيئي لـ CaBr2 هو 199.89 جم/مول. يتم حساب هذه القيمة عن طريق جمع الكتل الذرية لذرة كالسيوم واحدة وذرتين من البروم. يعد الوزن الجزيئي خاصية أساسية لأي مركب كيميائي لأنه يحدد كمية المادة الموجودة في جزيء المركب.
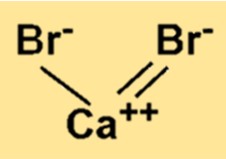
هيكل بروميد الكالسيوم
يحتوي CaBr2 على بنية شبكية بلورية تتكون من أيونات Ca2+ وBr−. أيونات Ca2+ محاطة بستة أيونات Br−، وكل أيون Br− محاط بستة أيونات Ca2+. وينتج عن هذا الترتيب للأيونات رابطة أيونية قوية بينهما.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 3,353 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 199.89 جرام/مول |
| كثافة | 3,353 جم/مل |
| نقطة الانصهار | 730 درجة مئوية (1,346 درجة فهرنهايت) |
| نقطة الغليان | 1,193 درجة مئوية (2,179 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الكحول والأسيتون والأثير |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | 7 (محايد) |
سلامة ومخاطر بروميد الكالسيوم
يعتبر CaBr2 آمنًا بشكل عام عند التعامل معه بشكل صحيح. ومع ذلك، فإنه يمكن أن يشكل بعض المخاطر الصحية إذا لم يتم التعامل معه أو استخدامه بشكل صحيح. قد يؤدي استنشاق أو ابتلاع CaBr2 إلى تهيج الجهاز التنفسي والجهاز الهضمي، على التوالي. قد يسبب ملامسة الجلد لفترة طويلة لـ CaBr2 تهيجًا والتهاب الجلد. يمكن أن يتفاعل CaBr2 أيضًا بعنف مع العوامل المؤكسدة القوية، مما يؤدي إلى إطلاق غازات سامة. يجب ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع CaBr2. ويجب أيضًا تخزينه في مكان بارد وجاف وجيد التهوية بعيدًا عن المواد غير المتوافقة.
| رموز الخطر | لا أحد |
| وصف الأمان | يسبب تهيج الجلد. يسبب تهيج العين خطيرة. ضار إذا ابتلع أو استنشق. قد يسبب تهيج الجهاز التنفسي. |
| أرقام تعريف الأمم المتحدة | UN3261 |
| رمز النظام المنسق | 28275900 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | ثالثا |
| تسمم | سمية منخفضة إلى متوسطة. |
طرق تصنيع بروميد الكالسيوم
هناك طرق مختلفة لتصنيع CaBr2، لكن الطريقة الأكثر شيوعًا تتضمن التفاعل بين كربونات الكالسيوم أو هيدروكسيد الكالسيوم وحمض الهيدروبروميك . تنتج هذه العملية CaBr2 والماء كمنتج ثانوي وحيد. يتم التفاعل في بيئة خاضعة للرقابة مع التحريك والتسخين المستمر لضمان التحويل الكامل للمواد المتفاعلة.
تتضمن الطريقة الأخرى التفاعل بين أكسيد الكالسيوم وحمض الهيدروبروميك . تنتج هذه العملية أيضًا CaBr2 والماء كمنتج ثانوي. التفاعل مشابه للطريقة الأولى ويتطلب التحريك والتسخين المستمر.
الطريقة الثالثة تتضمن التفاعل بين الكالسيوم والبروم. إن التفاعل العالي للبروم والحاجة إلى التعامل بعناية يجعل هذه الطريقة أقل استخدامًا. ينتج عن التفاعل CaBr2 باعتباره المنتج الوحيد.
تتطلب كل هذه الطرق معالجة دقيقة واحتياطات السلامة لأنها تحتوي على مواد كيميائية خطيرة وتفاعلات قد تكون خطرة. يجب تنقية CaBr2 المركب قبل استخدامه لإزالة أي شوائب والتأكد من نقائه. نقاء المنتج النهائي يحدد جودته وفعاليته للتطبيق المقصود.
استخدامات بروميد الكالسيوم
يجد CaBr2 تطبيقات مختلفة في صناعات مختلفة بسبب خصائصه الكيميائية الفريدة. بعض الاستخدامات الشائعة لـ CaBr2 هي:
- صناعة النفط والغاز: يستخدم في صناعة النفط والغاز كمائع استكمال للتحكم في ضغوط البئر أثناء عمليات الحفر والإكمال.
- الطب: يستخدم طبيًا كدواء مهدئ ومضاد للاختلاج لعلاج الصرع واضطرابات الجهاز العصبي الأخرى.
- التصوير الفوتوغرافي: يستخدم في التصوير الفوتوغرافي كمحسس لتحضير مستحلبات بروميد الفضة.
- التخليق الكيميائي: يستخدم كمحفز في التفاعلات الكيميائية المختلفة، بما في ذلك الأسترة والألكلة والتكثيف.
- مثبطات اللهب: تستخدم كمثبطات للهب في البلاستيك والمنسوجات وغيرها من المواد لتقليل مخاطر الحريق.
- صناعة الأغذية: يستخدم كمادة حافظة للأغذية لمنع نمو الميكروبات والفساد.
- التبريد: يستخدم كمبرد في أنظمة التبريد بالامتصاص.
- معالجة المياه: يستخدم في معالجة المياه لمنع نمو الطحالب والبكتيريا في حمامات السباحة وشبكات المياه الأخرى.
أسئلة:
س: ما الصيغة التي تمثل مركب بروميد الكالسيوم؟
ج: الصيغة الكيميائية لبروميد الكالسيوم هي CaBr2.
س: هل بروميد الكالسيوم قابل للذوبان في الماء؟
ج: نعم، CaBr2 قابل للذوبان في الماء. لديه قابلية عالية للذوبان في الماء، مع قابلية ذوبان حوالي 121 جم / 100 مل عند 20 درجة مئوية.
س: هل بروميد الكالسيوم مائي؟
ج: يمكن أن يتواجد CaBr2 في حالة مائية عندما يذوب في الماء، ليشكل محلولاً مائياً.
س: هل بروميد الكالسيوم قابل للذوبان؟
ج: نعم، CaBr2 قابل للذوبان في مذيبات مختلفة بما في ذلك الماء والإيثانول والأسيتون.
س: ما هو الراسب الذي يتشكل عند خلط المحاليل المائية لبروميد الكالسيوم وفوسفات البوتاسيوم؟
ج: عند خلط المحاليل المائية لمركب CaBr2 مع فوسفات البوتاسيوم يتكون راسب أبيض من فوسفات الكالسيوم. المعادلة الكيميائية المتوازنة لهذا التفاعل هي:
CaBr2(aq) + K3PO4(aq) → 2KBr(aq) + Ca3(PO4)2(s)
